O Il modello atomico di Schrödinger è una forma comune usata per designare il descrizione dell'atomo risolvendo l'equazione di Schrödinger, proposta dal fisico austriaco Erwin Schrödinger nel 1927. L'equazione è concepita sulla base di importanti osservazioni ottenute nell'ambito della meccanica quantistica, portando una solida giustificazione per l'energia dell'atomo e dell'elettrone.
L'atomo concepito da Schrödinger si basa sulla dualità onda-particella, sul principio di indeterminazione, tra le altre nozioni coniate all'inizio del XX secolo. Ha portato grandi progressi nella comprensione della materia, poiché ha aperto la strada a una comprensione più solida degli atomi polielettronici, cosa che non è possibile con il modello atomico proposto da Bohr.
Leggi anche tu: Modelli atomici: i modelli proposti per spiegare la struttura dell'atomo
Riassunto sul modello atomico di Schrödinger
Il modello atomico di Schrödinger è in realtà la descrizione dell'atomo e degli elettroni attraverso l'equazione di Schrödinger.
L'equazione di Schrödinger è stata sviluppata attraverso importanti studi nel campo della meccanica quantistica.
La dualità onda-particella, il principio di indeterminazione, tra le altre teorie, erano essenziali per la creazione dell'equazione di Schrödinger.
Risolvendo l'equazione di Schrödinger, è possibile descrivere l'energia dell'atomo così come quella dell'elettrone.
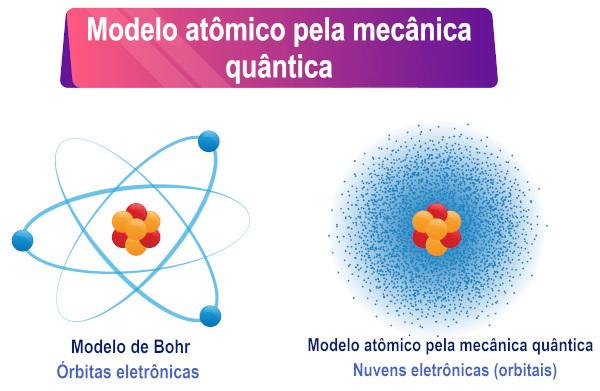
Sulla base dell'interpretazione dell'equazione di Schrödinger, si può vedere che gli elettroni non hanno un'orbita definita attorno all'atomo, ma piuttosto una regione di probabilità di esistenza intorno da lui.
Gli studi di Schrödinger ampliano il comprensione dell'atomo proposto da Bohr, in quanto consentono di comprendere il comportamento degli atomi polielettronici.
Cos'è il modello atomico di Schrödinger?
Il modello atomico di Schrödinger è un nome comune per il descrizione di un modello atomico basato sulla meccanica quantistica. La caratteristica principale di questo modello è l'interpretazione matematica della dualità onda-particella adottata dagli elettroni, di più in particolare, la sostituzione di una traiettoria ben definita dell'elettrone con la probabilità di esistenza dell'elettrone attorno al nucleo.
Tale interpretazione è iniziata attraverso il lavoro dello scienziato austriaco Erwin Schrödinger, nel 1927, dopo importanti progressi nella comprensione della materia nel campo della meccanica quantistica, come l'effetto fotoelettrico, il principio di indeterminazione e la dualità onda-particella.
La comprensione del modello atomico di Schrödinger non è banale, essendo avvicinata a livelli più avanzati dello studio della Chimica.
Basi sperimentali del modello atomico di Schrödinger
Prima degli studi di Erwin Schrödinger, ci furono importanti progressi nel comprensione della materia all'inizio del XX secolo. Tali esperimenti hanno avviato il campo della conoscenza teorica noto come meccanica quantistica, che porta interpretazioni sul comportamento delle particelle vicine o al di sotto della scala atomica. In questo specifico universo, le leggi della fisica classica, nota anche come fisica newtoniana, spesso non si applicano o non sono sufficienti a spiegare certi comportamenti.
Giusto per avere un'idea, possiamo dire che la meccanica quantistica inizia con un argomento noto come la catastrofe ultravioletta. Secondo la fisica classica, un corpo nero (oggetto caldo), con una temperatura diversa da zero, emette intense radiazioni ultraviolette, oltre a radiazioni gamma e raggi X.
Ciò significa che noi esseri umani, con la nostra temperatura di 36-37 °C, brilleremmo al buio (conseguenza dell'incandescenza). Inutile dire che questa è una totale assurdità, perché se lo fosse, non ci sarebbe oscurità.
In questo contesto, Nel 1900, Max Planck ha creato il concetto di Quanto, tradotto come “pacchetti di energia”, per spiegare lo scambio di energia tra materia e radiazione. Secondo la sua interpretazione, un corpo a basse temperature (come noi) non ha abbastanza energia per emettere radiazioni ultraviolette ad alta frequenza.
Pertanto, un corpo può emettere radiazioni ultraviolette ad alta frequenza solo quando acquisisce l'energia minima necessaria. In questa condizione lo scambio di energia tra materia e ambiente avviene attraverso pacchetti di energia radiante.
Anche i pacchetti energetici apportano una differenza rispetto alla fisica classica. Quando si parla di pacchetti di energia, ci si riferisce all'energia quantizzata, cioè è specifico, c'è un'imposizione di limiti. Nella fisica newtoniana, la quantità di energia scambiata tra due oggetti non ha restrizioni.
Effetto fotoelettrico
Per dare solidità alle teorie proposte da Planck, erano necessarie ulteriori prove. In questo contesto è apparso l'effetto fotoelettrico., che si occupa dell'espulsione di elettroni da un metallo attraverso l'incidenza della radiazione ultravioletta sulla sua superficie.
Secondo le osservazioni di questa teoria, nessun elettrone viene espulso finché la radiazione non raggiunge una frequenza di un certo valore, specifica per ogni metallo. Una volta raggiunta questa frequenza, gli elettroni vengono immediatamente espulsi, e più intensa è la frequenza della radiazione incidente, più veloce sarà l'elettrone espulso.
UN spiegazione per l'effetto fotoelettrico è stata data da Albert Einstein. Secondo Einstein, la radiazione elettromagnetica (la luce, per esempio, è radiazione elettromagnetica), utilizzata per l'espulsione di elettroni, era composta da particelle note come fotoni, e, inoltre, ogni fotone potrebbe essere interpretato come un pacchetto di energia. Sulla base degli studi di Planck, è stato possibile concludere che i fotoni della radiazione ultravioletta sono più energetici dei fotoni della luce visibile.

Quando collidono con la superficie del metallo, i fotoni (costituenti della radiazione elettromagnetica) scambiano energia con gli elettroni ivi presenti. Se l'energia assorbita dall'elettrone dalla collisione con i fotoni è abbastanza grande, allora verrà espulso. Per saperne di più sull'effetto fotoelettrico, clicca Qui.
dualità onda-particella
L'effetto fotoelettrico ha portato una solida base sul fatto che la radiazione elettromagnetica è composta da particelle (fotoni). Tuttavia, molti altri esperimenti hanno indicato che la radiazione elettromagnetica si comportava come un'onda. Di questi esperimenti, il più eclatante fu la diffrazione, il fenomeno fisico osservato quando un'onda incontra un ostacolo o, secondo un'altra interpretazione, il capacità delle onde di superare gli ostacoli.
O Il carattere ondulatorio della luce è noto dal 1801, quando il fisico inglese Thomas Young illuminò una barriera con una fenditura. Quando passa attraverso questa fenditura, la luce subisce una diffrazione. Ad ogni fenditura, compresa, che passa la luce, anche diffratta, subisce una nuova diffrazione.

Come questo, era necessario accettare un nuovo comportamento per la radiazione elettromagnetica: la dualità onda-particella. Da lì, lo scienziato francese Louis de Broglie ha ampliato questo concetto, suggerendo che anche tutte le particelle dovrebbero essere intese come aventi un comportamento ondulatorio.
L'ipotesi de Broglie si rafforzò nel 1925, quando gli scienziati americani Clinton Davisson e Lester Germer dimostrò che un fascio di elettroni era in grado di subire diffrazione quando passava attraverso un singolo cristallo di nichel.
Questa percezione era essenziale per arrivare alla conclusione che anche le particelle più pesanti, come le molecole, erano in grado di subire diffrazione e, quindi, esibire un comportamento ondulatorio. Per saperne di più sulla dualità onda-particella, clicca Qui.
principio di indeterminazione
Nella fisica classica, è facile determinare la traiettoria di una particella. Tuttavia, nel mondo quantistico, in cui anche le particelle si comportano come onde, la loro traiettoria non è più così precisa. Questo perché non ha senso parlare della posizione di un'onda.
Ad esempio, su una chitarra, quando pizzichi una corda, l'onda si estende per tutta la sua lunghezza. Se una particella ha lo stesso comportamento, non c'è nemmeno modo di definire esattamente la sua posizione conoscendo il suo momento lineare (quantità che mescola massa e velocità).
Pertanto, l'elettrone, anch'esso di carattere duale, non ha un'orbita/percorso definito intorno al nucleo atomico, come molti credono. UNla dualità crea quindi incertezza sulla posizione esatta della particella.
Questa incertezza nella definizione della posizione è trascurabile per corpi molto pesanti, ma pienamente significativa per corpi di dimensioni atomiche o subatomico, cioè se sai che la particella è in un certo posto, in un certo momento, non saprai più dove sarà nel prossimo immediato.
Da questo dilemma è nato il principio di indeterminazione., stabilito dal fisico tedesco Werner Heisenberg nel 1927. Secondo questo principio, non è possibile conoscere la posizione e il momento lineare di una particella senza margine di errore, cioè se una proprietà è nota, l'altra no. Per saperne di più sul principio di indeterminazione, clicca Qui.
Caratteristiche del modello atomico di Schrödinger
Poiché, dal carattere duale della particella, non era più possibile definire per essa una specifica traiettoria, nel 1927 lo scienziato austriaco Erwin Schrödinger ha sostituito questa precisa traiettoria con una funzione d'onda, rappresentato dalla lettera greca psi (ψ), con i valori di questa funzione che variano a seconda della posizione. Un esempio di funzione d'onda è la funzione seno di X.
Lo scienziato Max Born ha quindi creato un'interpretazione fisica per la funzione d'onda, affermando che il quadrato della funzione ψ, cioè ψ², sarebbe proporzionale alla probabilità di trovare una particella in regione. Pertanto, ψ² è inteso come la densità di probabilità di trovare una particella in una regione. Trattandosi di una densità di probabilità, il valore di ψ² deve essere moltiplicato per il volume per ottenere la vera probabilità.
Per calcolare la funzione d'onda, Schrödinger ha sviluppato un'equazione, semplificato come segue:
Hψ = Eψ
Hψ dovrebbe essere letto come “psi hamiltoniano”, e descrive la curvatura della funzione d'onda. L'Hamiltoniano è un operatore matematico, proprio come il più, il meno, il log, ecc. Il lato destro ci porta l'energia corrispondente.
La soluzione di questa equazione ci porta a una conclusione importante: le particelle possono avere solo energie discretes, cioè energie ben determinate, o quantizzate, e non alcun valore. Questi valori energetici specifici sono noti come livelli di energia. Questa è un'imposizione della funzione d'onda, poiché deve adattarsi a una specifica regione dello spazio. Nella meccanica classica, un oggetto può avere qualsiasi valore di energia totale.
Come questo, un elettrone non può avere alcuna energia, ma livelli di energia ben definiti. Poiché la funzione d'onda deve adattarsi a una regione dello spazio, ricorda che a l'elettrone è confinato all'interno di un atomo attraverso le forze di attrazione che ha per il nucleo.
I livelli di energia di un atomo possono essere calcolati risolvendo opportunamente l'equazione di Schrödinger. In questo caso si nota che la risoluzione raggiunge una nuova equazione, che dimostra che l'energia di ogni livello dell'atomo dipende da un numero intero, chiamato N, che corrobora l'idea che i livelli di energia abbiano valori specifici.
Quindi, assegnando valori positivi a N (1, 2, 3...), è possibile calcolare l'energia dei livelli atomici. Il parametro N è ora chiamato il numero quantico principale, poiché finisce per essere collegato a ciascun livello atomico consentito per un atomo.
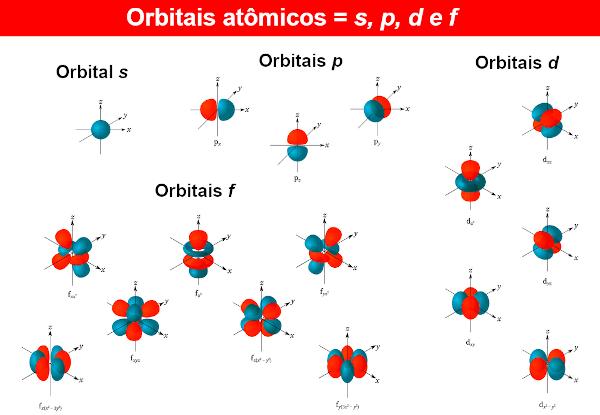
Al le funzioni d'onda degli elettroni sono chiamate orbitali atomici, le cui espressioni matematiche si ottengono anche risolvendo l'equazione di Schrödinger. Un orbitale atomico presenta la distribuzione dell'elettrone in un atomo, cioè la regione di probabilità di esistenza di un elettrone in un atomo. Gli orbitali atomici possono avere forme ed energie diverse, ottenute anche dall'equazione di Schrödinger.
Per ogni livello di energia N (Ricordandolo N può essere 1, 2, 3...), ci sono N sottolivelli. In ogni sottolivello ci sono orbitali di forme diverse. Non c'è limite ai diversi orbitali, ma degli atomi finora conosciuti i chimici ne usano solo quattro, identificati dalle lettere S, P, D È F.
Quindi, ad esempio, a livello N = 1, c'è solo un sottolivello, quindi c'è solo l'orbitale S. Ora per il livello N = 2, ci sono due sottolivelli, essendo presenti gli orbitali S È P.
Progressi del modello atomico di Schrödinger rispetto ad altri modelli atomici
Come accennato, Schrödinger non ha necessariamente presentato un modello ma un'interpretazione matematica. per i fenomeni osservati riguardanti la natura delle particelle. Pertanto, la sua interpretazione diventa complessa, poiché la stessa equazione di Schrödinger necessita di conoscenze matematiche avanzate per la sua risoluzione e anche per la sua interpretazione.
comunque, il Gli studi di Schrödinger hanno portato una grande robustezza per giustificare l'energia di atomi ed elettroni i regali. Ad esempio, la risoluzione dell'equazione di Schrödinger conferma il modello atomico di Bohr per l'atomo di idrogeno e altri atomi idrogenoidi (quelli che hanno solo 1 elettrone). Come Schrödinger, Bohr arrivò ai livelli di energia ammissibili per l'atomo di idrogeno.
Tuttavia, il modello atomico di Bohr non è in grado di raggiungere livelli elettronici per atomi con più di 1 elettrone e, quindi, dimostra la sua principale debolezza. Quando sono presenti due elettroni, è necessario considerare la repulsione elettronica tra di loro, un parametro che può essere aggiunto alla comprensione matematica proposta da Schrödinger.
Un altro punto importante degli studi di Schrödinger è l'adattamento di concetti quantistici, come la dualità della particella, così come una traiettoria esatta per un elettrone. La definizione di orbitale atomico è molto importante per comprendere il struttura di tutti gli atomi. UN la densità di probabilità (ψ²) ci aiuta a capire come gli elettroni occupano gli orbitali atomici negli atomi polielettronici, portando informazioni più specifiche sull'energia dell'elettrone.
Di Stefano Araujo Novais
Insegnante di chimica
Fonte: Scuola Brasile - https://brasilescola.uol.com.br/quimica/modelo-atomico-de-schrodinger.htm


