IL ruterfordio è un elemento sintetico di numero atomico 104, appartenente al gruppo 4 del Tavola periodica, essendo il primo membro della serie dei transattinidi. La sua prima scoperta risale al 1964, nei famosi laboratori della città di Dubna. Come altri transattinidi, il nome ufficiale dell'elemento 104 è stato coinvolto in un conflitto tra sovietici e americani, in un pezzo sulla guerra fredda nella storia della chimica.
il ruterfordio non ha applicazioni pratiche, dato che il suo isotopo più stabile ha circa due ore e mezza di metà vita. Tuttavia, studi su sistemi e soluzioni gassose dimostrano la sua somiglianza chimica con gli altri elementi del gruppo 4, come zirconio e afnio.
Leggi anche: Seaborgium — elemento sintetico che prende il nome dallo scienziato Glenn Seaborg
Riassunto di Rutherfordium
- È un elemento chimico sintetico situato nel gruppo 4 della tavola periodica.
- Fu sintetizzato per la prima volta nel 1964 presso l'Istituto congiunto per la ricerca nucleare di Dubna, in Russia.
- È un elemento radioattivononna.
- Come altri transattinidi, il ruterfordio soffre di bassa stabilità ed è difficile sintetizzare campioni considerevoli per gli studi.
- Il suo nome è stato ufficializzato solo nel 1997, dopo diversi anni di contese tra americani e sovietici.
Proprietà del ruterfordio
- Simbolo: Rf
- numero atomico: 104
- massa atomica: 267 c.u.s.
- Configurazione elettronica: [Rn] 7s2 5f14 6d2
- isotopo più stabile: 267Rf (2,5 ± 1,5 ore di emivita)
- serie chimica: gruppo 4, transattinidi, elementi superpesanti
Non fermarti ora... C'è altro dopo l'annuncio ;)
Caratteristiche di Rutherfordium
Come tutti i transattinidi, cioè gli elementi subito dopo Laurence (Lr), il ruterfordio è un elemento radioattivo. Il suo isotopo più stabile è stato rilevato nel 2004 e la sua emivita (il tempo richiesto per la quantità di radioisotopo caduta della metà) è di due ore e mezza, con un margine di errore di un'ora e mezza, più o meno.
La grande difficoltà nello stabilire le caratteristiche chimiche del ruterfordio e altri transattinidi è, in generale, il fatto che c'è un basso tasso di produzione, sia in quantità che in velocità. In questi elementi, ad esempio, è molto comune valutarne chimicamente solo uno atomo, che, in un certo senso, richiede adattamenti in termini di calcoli, poiché la maggior parte delle equazioni sono stabilite per sistemi con più di un atomo. Inoltre, spesso il gli isotopi hanno un'emivita molto breve, il che rende difficili o addirittura impossibili studi più approfonditi.
Nel caso specifico di Rf, gli scienziati sono già riusciti a dimostrare che il suo comportamento in fase liquida è simile a quello di altri elementi. gruppo più leggero 4, zirconio e afnio, come nella formazione di fluoruri in soluzione con successiva estrazione in resine a scambio ionico. Questo comportamento ha contribuito a consolidare la presenza di ruterfordio nel gruppo 4 della tavola periodica.
Leggi anche tu: Nuovi elementi chimici: i quattro elementi mancanti nel 7° periodo
Ottenere Rutherfordium
I transattinidi hanno bisogno di una grande infrastruttura per la loro produzione. Tutto sono sintetizzati con acceleratori di particelle, in cui le specie ioniche si scontrano con elementi pesanti. Anche il rilevamento di questi elementi non è semplice e diretto.
Quando si forma, l'elemento radioattivo, per sua natura, inizia a decadere ed esibisce emissioni, come particelle alfa e beta. Spesso è necessario valutare il decadimento radioattivo dell'atomo formato o anche identificare specie atomiche che possono derivare da queste reazioni nucleari, come in un puzzle.
Aggiungi questo al fatto che le emivite degli isotopi transattinidi sono spesso brevi, nell'intervallo di secondi, consentendo di ottenere solo una quantità nell'intervallo di pochi atomi o anche uno solo atomo.
Nel caso di Rf, la prima sintesi riportata per questo elemento ha riguardato il collisione di isotopi di plutonio, Pu, con ioni di neon isotopo 22, Eh.
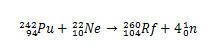
Tuttavia, altri isotopi del ruterfordio possono essere prodotti modificando le specie che entreranno in collisione. Ad esempio, l'isotopo 261 può essere prodotto dalla reazione tra ossigeno-18 e curio-248, producendo cinque neutroni.
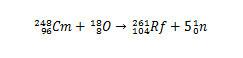
Dai un'occhiata al nostro podcast: Come funziona un acceleratore di particelle?
Precauzioni con Rutherfordium
Poiché il rutherfordio non può essere prodotto nemmeno su larga scala, i rischi associati a questo elemento sono legati al effetti di radiazione. Tuttavia, in un laboratorio controllato, questi rischi sono previsti e quindi ridotti al minimo.
Storia di Rutherfordium

Tutti i transattinidi sono stati coinvolti in una corsa per la loro scoperta negli anni '60 e '70. Questo episodio è segnalato come il War of Transfers, un pezzo del Guerra fredda nella storia della chimica. Nonostante sia chiamato così, il che suggerisce che le controversie si siano verificate su elementi dopo fermium, un elemento numero atomico 100, gli elementi direttamente coinvolti erano da 104 a 109, quelli appena scoperti transattinidi.
Nel caso del rutherfordium, la controversia iniziò nel 1964., quando i ricercatori sovietici presso l'Istituto congiunto per la ricerca nucleare nella città di Dubna Russia, ha riportato la scoperta dell'isotopo 260 dell'elemento 104 bombardando il plutonio-242 con ioni neon-22. Ma i ricercatori di Dubna hanno presentato solo una prova, che era il rilevamento di un isotopo che è decaduto spontaneamente, senza identificare chiaramente la sua massa e il suo tempo di metà vita. Di conseguenza, la scoperta è stata vista con sospetto.
Cinque anni dopo, nel 1969, un team di scienziati americani al Lawrence Berkeley National Laboratory di Berkeley, in California, guidato da Albert Ghiorso, ha affermato di aver fornito prove sufficienti per la scoperta dell'isotopo 257 dell'elemento 104 mediante la collisione del californio-249 con carbonio-12. Gli stessi scienziati sono stati successivamente in grado di produrre l'isotopo 259 dell'elemento 104. Nel 1973, gli scienziati dell'Oak Ridge National Laboratory hanno confermato in modo indipendente il numero atomico 104 per l'isotopo di massa 257 prodotto a Berkeley.
Gli anni successivi furono di grande contesa tra gli scienziati dei due paesi, fino a quando, nel 1985, il di chimica pura e applicata (IUPAC) e l'Unione internazionale di fisica pura e applicata (IUAP) forma a commissione mista di nove scienziati, denominata Transfers Working Group (Gruppo di lavoro Transfermium o TWG). Il TWG è stato creato per decidere chi fosse effettivamente responsabile delle scoperte degli elementi che vanno da 101 a 112.
Anche così, le decisioni del TWG non erano sempre prive di dubbi. Nel caso dell'elemento 104, il gruppo di lavoro ha deciso che il Il merito dovrebbe essere condiviso tra scienziati sovietici e americani, qualcosa che agli scienziati di Berkeley non è piaciuto affatto.
Nel 1991 Ghiorso e Seaborg, del team di Berkeley, affermarono addirittura che l'identificazione dell'elemento 104 da parte degli scienziati Dubna era chiaramente sbagliato e, a un certo punto, ha negato la validità delle conclusioni di TWG, considerandole un disservizio alla comunità scientifico.
Non c'è da stupirsi, dentro All'inizio degli anni '90, i nomi dei nuovi elementi non erano ancora un consenso.. Ci sono stati poi negoziati che hanno coinvolto scienziati tedeschi, russi e americani, che si sono rivelati frustrati. Lì, nel 1992, il laboratorio tedesco Gesellschaft für Schwerionenforschung (GSI) ha proposto nomi per gli elementi da 102 a 109, mettendo meitnerium per l'elemento 104.
Anche così, l'elenco, nonostante sia stato elogiato, non è stato accettato dagli scienziati coinvolti. La decisione potrebbe essere presa nel 1994, durante la conferenza della Iupac Inorganic Compound Nomenclature Commission (CNIC). In esso, il nome dubnium è stato scelto per l'elemento 104, tuttavia, l'American Chemical Society ha adottato, nello stesso anno, il nome rutherfordium per l'elemento 104. elemento 104, in un momento di discredito da parte degli americani, venuti a mettere in discussione l'autorità della IUPAC per formalizzare nuove nomi.
solo nel 1997, alla conferenza generale IUPAC di Ginevra, è quello l'elemento 104 è stato finalmente ufficializzato come rutherfordium, dopo che l'ACS ha ceduto il passo nella nomenclatura di altri elementi vicini.
Esercizi risolti su rutherfordium
domanda 1
Il rutherfordium è un elemento sintetico e una delle maggiori difficoltà nello studiarlo è il fatto che non è possibile sintetizzarne grandi quantità.
Tra i possibili fattori che contribuiscono a questa difficoltà, possiamo indicare:
(A) Il rutherfordio ha isotopi di lunga emivita dell'ordine di milioni di anni.
(B) Il rutherfordium decade spontaneamente e molto rapidamente, impedendo il rilevamento delle sue quantità macroscopiche.
(C) Non esistono tecnologie in grado di sintetizzare il ruterfordio, essendo i loro dati strettamente teorici e privi di basi scientifiche.
(D) Le leggi della chimica affermano che è impossibile sintetizzare elementi il cui numero atomico superi quello di Lawrence, 103.
(E) Durante la sintesi del ruterfordio, gli elementi più leggeri del suo gruppo hanno la priorità chimica.
Rispondere: lettera b
Gli elementi transattinidi, come Rf, sono radioattivi e decadono spontaneamente ad alta velocità, poiché la loro emivita è breve. Così, alla fine dell'esperimento, della specie sintetica rimangono pochi atomi.
Domanda 2
Nel 1964, i ricercatori di Dubna affermarono di aver sintetizzato l'isotopo-260 del ruterfordio (Z = 104). Nel caso di questo isotopo, qual è il numero di neutroni?
(A) 104
(B) 260
(C) 151
(D) 156
(E) 161
Rispondere: lettera D
Il numero di neutroni (n) può essere calcolato, utilizzando il numero di massa (A) e il numero atomico (Z), attraverso la seguente equazione:
A = Z + n
Sostituendo abbiamo:
260 = 104 + n
n = 260 - 104
n = 156
crediti immagine
[1] abba rosati / persiane
Di Stefano Araújo Novais
Insegnante di chimica



