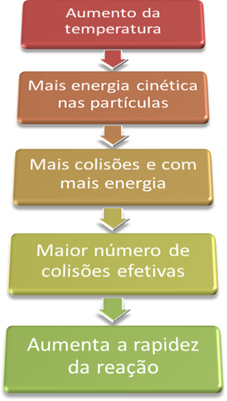
Maggiore è la temperatura, maggiore è la velocità di reazione.
Questo può essere facilmente visto in molte situazioni della nostra vita quotidiana, come nei seguenti esempi:
- Quando vogliamo rallentare la reazione di decomposizione di un alimento, abbassiamo la temperatura, mettendolo in frigo;

- Se vogliamo accelerare la reazione di cottura del cibo, basta metterlo in una pentola. pressione che, all'aumentare della pressione, aumenta anche la temperatura di ebollizione dell'acqua liquida in cui il cibo è;

- Gli incendi, in genere, sono solitamente devastanti perché la temperatura dell'ambiente aumenta, il che provoca un aumento della velocità della reazione di combustione;
- Per rallentare i processi chimici metabolici, diminuendo le possibilità di danni cerebrali dovuti a carenza di ossigeno, alcuni interventi chirurgici vengono eseguiti abbassando la temperatura corporea del paziente, raggiungendo circa 15°C;
- Se mettiamo una compressa effervescente in un bicchiere di acqua calda e un'altra in un bicchiere di acqua fredda, la prima si dissolverà molto più velocemente.
Ma cosa spiega l'influenza direttamente proporzionale della temperatura sulla velocità di reazione?
Questo perché, come spiegato nel testo “Condizioni per il verificarsi di reazioni chimiche”, affinché una reazione proceda, è necessario soddisfare alcune condizioni, come ad esempio che le particelle devono collidere efficacemente e con l'energia minima richiesta, che si chiama energia di attivazione.
Quindi, quando aumentiamo la temperatura del sistema, aumentiamo anche l'agitazione delle particelle che reagiscono e forniamo loro più energia cinetica. Con questo, si verificheranno più collisioni e con più energia, aumentando la quantità di particelle che reagiranno e, di conseguenza, aumentando la velocità di reazione.
di Jennifer Fogaça
Laureato in Chimica
Fonte: Scuola Brasile - https://brasilescola.uol.com.br/quimica/temperatura-velocidade-das-reacoes.htm