Uno composto polare (o sostanza) è uno che ha due regioni con diverse densità di elettroni. Una di queste regioni ha un carattere positivo (area bianca) e un'altra ha un carattere negativo (area gialla), come possiamo vedere nella seguente rappresentazione:

Rappresentazione di regioni di diversa carica in un composto polare
Sapere se un certo il composito è polare implica conoscere il tipo di forza intermolecolare che favorisce l'interazione tra le sue molecole o con molecole di altre sostanze, oltre a formulare ipotesi sulla loro solubilità e sui punti di fusione e bollente.
Ad esempio: per quanto riguarda la solubilità, i composti polari hanno una buona capacità di dissolversi in composti polari. Per quanto riguarda le forze intermolecolari, a seconda dei casi, i composti polari possono interagire per forze dipolo permanente o legami idrogeno (forza che si traduce anche in punti di fusione più elevati e bollente).
Ecco due modi pratici per determinare se un composto è polare o meno.
Determinazione della polarità attraverso il numero di nuvole e il numero di ligandi
Possiamo determinare se a il composito è polare dalla relazione tra il numero di atomi uguali attaccati all'atomo centrale e il numero di nuvole di elettroni in quell'atomo centrale.
Nota: Una nuvola di elettroni è un qualsiasi legame chimico tra due atomi o una coppia di elettroni dal guscio di valenza di un atomo che non partecipano a un legame.
Se il numero di nubi presenti nell'atomo centrale è diverso dal numero di ligandi uguali in quell'atomo centrale, abbiamo un composto polare. Per capire meglio, segui gli esempi seguenti:
1° Esempio: Molecola di acido cianidrico
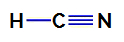
Formula di struttura dell'acido cianidrico
Nell'acido cianidrico, l'atomo centrale è il carbonio, che ha quattro elettroni nella sua strato di valenza per l'appartenenza alla famiglia IVA della tavola periodica. Come il carbonio sta creando un singolo legame (condividendo due elettroni, con un elettrone da ciascun atomo coinvolti) con idrogeno e un triplo legame con azoto, quindi non ci sono elettroni di non legame nell'atomo centrale.
Quindi, nell'acido cianidrico, vi è la presenza di due nuvole elettroniche (un singolo legame e un triplo legame) e un ligando uguale all'altro. Pertanto, è un composto polare.
2° Esempio: Molecola di ammoniaca (NH3)
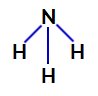
Formula strutturale ammoniaca
Nell'ammoniaca, l'atomo centrale è l'azoto, che ha cinque elettroni nel suo guscio di valenza poiché appartiene alla famiglia VA della tavola periodica. Poiché l'azoto forma un singolo legame (condivisione di due elettroni, con un elettrone di ciascun atomo coinvolto) con ciascun atomo di idrogeno, due dei suoi cinque elettroni non partecipano ai legami.
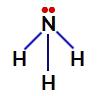
Elettroni non leganti l'azoto nell'ammoniaca
Quindi, nell'ammoniaca, ci sono quattro nuvole di elettroni (tre legami singoli e la coppia di elettroni non leganti) e tre ligandi uguali (i tre idrogeni). Quindi è un composto polare.
Determinazione della polarità attraverso il vettore del momento dipolare di un composto
Possiamo determinare se a il composito è polare dall'analisi del risultante vettore momento di dipolo nella sua formula strutturale, tenendo conto della sua geometria molecolare e la differenza di elettronegatività tra gli atomi coinvolti.
Nota: Ordine decrescente di elettronegatività degli elementi: F > O > N > Cl > Br > I > S > C > P > H.
Quando la somma dei vettori presenti nella molecola è diversa da zero, il composto sarà polare. Per capire meglio, segui i seguenti esempi:
1° Esempio: molecola di triclorometano
Il triclorometano è un composto che presenta geometria tetraedrica, come possiamo vedere nella sua formula di struttura di seguito:

Formula di struttura del triclorometano
Per sapere se si tratta o meno di un composto polare, dobbiamo inizialmente posizionare i vettori del momento dipolare (frecce che indicano quale atomo è più stabile dell'altro) in quello strutturale, come nell'esempio seguente:
Nota: Il cloro è un elemento più elettronegativo del carbonio. A sua volta, il carbonio è un elemento più elettronegativo dell'idrogeno.
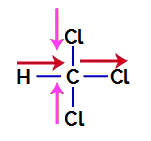
Vettori del momento dipolare in triclorometano
I vettori in rosa possono essere rappresentati da +x e -x, poiché hanno la stessa direzione (verticale) e direzioni opposte (su e giù). I vettori in rosso sono rappresentati da +x, poiché hanno la stessa direzione e la stessa direzione. Pertanto, il vettore del momento dipolare risultante (somma dei vettori) è rappresentato da:
μR = (+x) + (-x) + (+x) + (+x)
μR = +X – x + x + x
μR = 2x
Poiché il vettore del momento di dipolo risultante è diverso da zero, abbiamo a composto polare.
2° Esempio: molecola d'acqua
L'acqua è un composto che presenta geometria angolare, come possiamo vedere nella sua formula di struttura di seguito:
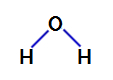
Formula strutturale dell'acqua
Per scoprire se si tratta o meno di un composto polare, dobbiamo inizialmente posizionare i vettori del momento dipolare (frecce che indicano quale atomo è più stabile dell'altro) nella struttura, come mostrato di seguito:
Nota: L'ossigeno è un elemento più elettronegativo dell'idrogeno.
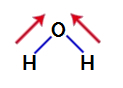
vettori momento dipolo in acqua
Poiché i due vettori nella struttura dell'acqua sono diagonalmente trasversali, dobbiamo usare la regola del parallelogramma. In questa regola, quando colleghiamo le basi dei vettori, abbiamo la creazione di un vettore risultante (che sostituisce i due usati in precedenza), come nel modello seguente:
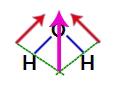
Vettore risultante nella formula strutturale dell'acqua
Poiché la molecola d'acqua ha un singolo vettore, quindi, il vettore del momento dipolare risultante è diverso da zero, cioè abbiamo un composto polare.
Di Me. Diogo Lopes Dias
Fonte: Scuola Brasile - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-um-composto-polar.htm
