Kps è l'acronimo usato per rappresentare la costante del prodotto di solubilità, che si riferisce al prodotto (moltiplicazione) del concentrazioni in quantità di materia degli ioni presenti in una soluzione.
Ogni volta che un soluto scarsamente solubile viene aggiunto a un solvente come il solfato di bario, una piccola quantità di parte di questo sale si scioglie nell'acqua, e il resto si accumula sul fondo del recipiente, formando il corpo di sfondo. Il sale che si scioglie soffre dissociazione, rilasciando cationi e anioni nell'acqua.

Precipitato presente in una soluzione con acqua e solfato di bario
Inoltre il sale non si presenta bene solubilità, la quantità di soluto disciolto non cambia nel tempo perché c'è un equilibrio di dissoluzione tra gli ioni di sale (presenti nella soluzione) e il corpo di fondo.

Bilanciamento della dissoluzione di BaSO4 in acqua
Kps di un soluto
oh Kps di un soluto è il prodotto delle concentrazioni molari degli ioni partecipanti. È sempre necessario elevare la concentrazione di ioni al rispettivo coefficiente stechiometrico (utilizzato per bilanciare l'equazione).

Equilibrio di dissoluzione dell'elettrolita YIlXB
oh Kps dell'equilibrio proposto per il sale YIlXB avrà la concentrazione del reattivo Y (elevato al suo coefficiente stechiometrico (a) e la concentrazione del prodotto X (elevato al suo coefficiente stechiometrico (b)).
Kps = [Y+b]Il.[X-Il]B
Esempio
Supponiamo di preparare una soluzione con acqua e cianuro di alluminio [Al(CN)3], che è un sale praticamente insolubile in acqua. Quando questo sale viene aggiunto all'acqua, finisce per subire il fenomeno della dissociazione.

Equilibrio di dissoluzione dell'elettrolita di Al (CN)3
Quindi, attraverso l'equazione dell'equilibrio della dissoluzione del sale, si ha che il suo Kps avrà la moltiplicazione della concentrazione del catione alluminio (Al+3) elevato all'esponente 1 dalla concentrazione di anione cianuro (CN-1) elevato all'esponente 3.
Kps = [Al+3]1.[CN-1]3
Kps significati di un soluto
Quando troviamo il Kps di un particolare sale mescolato con acqua, conosciamo anche la concentrazione di ciascuno degli ioni nella soluzione. Con questi dati, possiamo determinare il rango di una soluzione o il comportamento del soluto nella soluzione. Considera il seguente equilibrio:

Equilibrio di dissoluzione dell'elettrolita YIlXB
Possiamo stabilire le seguenti relazioni:
Se Kps = [Y+b]Il.[X-Il]B = 0, abbiamo una soluzione satura senza presenza di precipitato;
Se Kps > [Y+b]Il.[X-Il]B = 0, abbiamo una soluzione insatura, cioè una bassa quantità di soluto disciolto nel solvente (in relazione a coefficiente di solubilità);
Se Kps < [Y+b]Il.[X-Il]B = 0, abbiamo una soluzione satura con un corpo di fondo, cioè si avrà una precipitazione dell'elettrolita (soluto);
Se il valore Kps dell'elettrolita è troppo basso, si tratta di un materiale poco solubile nel solvente.
Esempio di Calcolo Kps di un soluto
(UEN): La solubilità del nitrato di calcio [Ca (NO3)2] in acqua è 2.0. 10–3 mol/litro ad una certa temperatura. Il Kps di questo sale alla stessa temperatura è:
a) 8.10–8.
b) 8.10–10.
c) 3.2.10–10
d) 3.2.10–8
Dati di esercizio:
Formula del sale: Ca (NO3)2;
Concentrazione di sale molare (solubilità): 2.0. 10–3 mol/l.
Per risolvere e calcolare Kps, devi fare quanto segue:
Passo 1: Imposta la bilancia per la dissoluzione del sale.
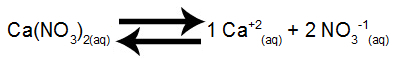
Equilibrio di dissoluzione del nitrato di calcio in acqua
Il nitrato di calcio, quando si dissocia in acqua, rilascia 1 mole di cationi di calcio (Ca+2) e 2 moli di anioni nitrato (NO3-1).
Passo 2: Assemblare l'espressione del Kps del sale
Il Kps di questo sale sarà il prodotto della concentrazione del catione calcio elevato all'esponente 1 per la concentrazione dell'anione nitrato elevato all'esponente 2, come mostrato di seguito:
Kps = [Ca+2]1.[AL3-1]2
Passaggio 3: Determinare i valori delle concentrazioni di ioni nella soluzione
Per calcolare il Kps, abbiamo bisogno dei valori delle concentrazioni di ioni, tuttavia l'esercizio prevedeva la molarità del sale nella soluzione. Per determinare la concentrazione di ogni ione basta moltiplicare la molarità del sale per il coefficiente stechiometrico del partecipante alla reazione:
Per il catione di calcio:
[Qui+2] = 1. 2,0. 10–3
[Qui+2] = 2,0. 10–3 moli/L
Per l'anione nitrato:
[AL3-1] = 2. 2,0. 10–3
[AL3-1] = 4,0. 10–3 moli/L
Passaggio 4: Utilizzare i valori di concentrazione trovati nel passaggio 3 nell'espressione Kps (determinato nel passaggio 2).
Kps = [Ca+2]1.[AL3-1]2
Kps = [2.10-3]1.[4.10-3]2
Kps = 2.10-3.16.10-6
Kps = 32,10-9
o
Kps = 3.2.10-9 (mese/giorno)
Di Me. Diogo Lopes Dias
Fonte: Scuola Brasile - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-kps.htm
