I solfati sono composti ionici che contengono l'anione SO42-, che è chiamato anione solfato.
Lo zolfo è un elemento della famiglia 16 o VI-A, il che significa che ha 6 elettroni nel suo guscio di valenza. Secondo la regola dell'ottetto, dovrebbe ricevere 2 elettroni in più per avere 8 elettroni nell'ultimo guscio elettronico ed essere quindi stabile. Ma lo zolfo subisce espansione di ottetto, essendo un elemento situato nel terzo periodo della Tavola Periodico, essendo relativamente grande, che gli consente di ospitare più di otto elettroni al suo in giro.
Pertanto, come si può vedere di seguito, il livello di valenza dello zolfo si espande per ospitare un totale di 12 elettroni. Ma due atomi di ossigeno non sono ancora stabili, ciascuno con sette elettroni nel guscio di valenza, quindi hanno bisogno di ricevere un altro elettrone per stabilizzarsi. Per questo motivo, la carica di ciascuno di questi due atomi è -1, risultando in una carica totale per l'anione di -2:
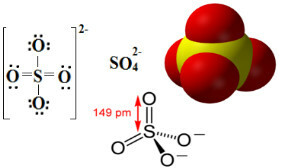
L'anione solfato può provenire dall'acido solforico (H2SOLO4(ac)) mostrato di seguito:
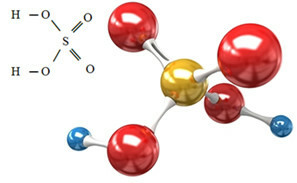
L'acido solforico reagisce con alcune basi, in una reazione neutralizzante, formando un sale inorganico, che è il nostro solfato, e anche acqua:
Reazione generica: acido solforico + base → Sale (solfato) + Acqua
H2SOLO4 + 2 ÇOh →Ç2SOLO4+ 2 H2oh
Vedere un esempio di seguito in cui si forma solfato di potassio:
H2SOLO4 + 2 KOH →K2SOLO4+ 2 H2oh
Nota che la nomenclatura di un solfato è fatta semplicemente dalla regola: solfato + nome dell'elemento ad esso collegato. Inoltre, le formule per i solfati sono realizzate scambiando la carica di ogni ione con l'indice dell'elemento, senza dover scrivere l'indice "1":
Esempi:
A+1 SOLO42- → A2SOLO4→ solfato di sodio
mg+2 SOLO42- → MgSO44→ solfato di magnesio
Qui+2 SOLO42- → Astuccio4→ solfato di calcio
Ba+2 SOLO42- → BASO4→ solfato di bario
Al+3 SOLO42- → Al2(SOLO4)3→ solfato di alluminio
I sali contenenti lo ione solfato sono generalmente solubili in acqua, le eccezioni sono quattro: solfato di calcio (CaSO4), solfato di stronzio (SrSO4), solfato di bario (BaSO4) e solfato di piombo (PbSO4). Questo perché esiste un'elevata energia di legame tra questi cationi (Ca2+, signore2+, Ba2+ e Pb2+) e il solfato, poiché hanno tutti carica +2 e l'anione solfato ha carica -2. Pertanto, interrompere tale connessione diventa più difficile.
I solfati si trovano sotto forma di reticoli cristallini, per l'attrazione che le cariche opposte esercitano l'una sull'altra, come mostrato di seguito nel caso del solfato di rame (CuSO4):

I solfati si trovano in natura principalmente sotto forma di minerali. Vedi alcuni esempi:
barita → solfato di bario;
Gesso → solfato di calcio;
Celestite → solfato di stronzio;
angoliok → solfato di piombo;
Glauberite → doppio calcio e solfato di sodio: CaNa2(SOLO4)2;
Allume di potassio (kalinite) → solfato di alluminio e potassio doppio idrato: KAl (SO4)2.11H2oh
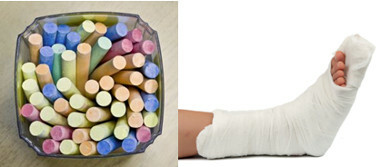
Tra i principali solfati nella vita di tutti i giorni, abbiamo il solfato di calcio, che in forma anidra (senza acqua) viene utilizzato nella fabbricazione del gesso scolastico. Quando è in forma diidrata, (CaSO4 .2h2O), è noto come gesso ed è più abbondante. Per riscaldamento, forma solfato di calcio emiidrato (CaSO4. ½H2O), che è gesso, utilizzato in ortopedia, stampi dentali, edilizia civile e vernici.
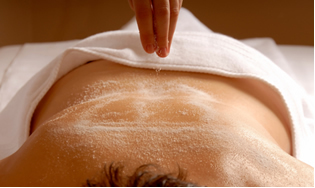
Un altro sale importante è il ssolfato di magnesio (MgSO44), noto come sbitter al o sale di Epsom, che ha un'azione lassativa e viene utilizzato per massaggi e bagni rilassanti.
di Jennifer Fogaça
Laureato in Chimica
