La molecola è un insieme di atomi, uguali o diversi, uniti da legami covalenti.
Queste specie chimiche sono elettricamente neutre e rappresentano l'unità formante di una sostanza.
Esistono molecole semplici come l'ossigeno (O2) dell'aria che respiriamo. Tuttavia, ci sono anche composti complessi, come buckyballs (60 atomi di carbonio legati a forma di sfera), che sono le più grandi molecole mai trovate nello spazio.
Studio della molecola
Il legame covalente in una molecola corrisponde alla condivisione di elettroni, solitamente tra elementi non metallici.
Vedi la molecola d'acqua come un esempio di un composto semplice.

Quando osserviamo un bicchiere con acqua non abbiamo idea che questa sostanza sia composta da diverse molecole di H2O. Questa formula indica che l'acqua è composta da 3 atomi: due atomi di idrogeno e uno di ossigeno, che condividono gli elettroni tra loro.
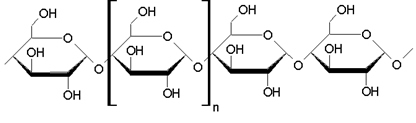
Anche lo zucchero, che usiamo per addolcire i succhi e per fare le torte, è costituito da molecole. L'unità formante dello zucchero è il saccarosio.

Questa molecola è molto più complessa, poiché ci sono 45 atomi collegato. È formato da: 12 atomi di carbonio, 22 atomi di idrogeno e 11 atomi di ossigeno.
Le molecole sono strutture di massa molecolare nota, ma esistono anche macromolecole, che sono "strutture giganti" formate da così tanti atomi che la loro composizione è addirittura indefinita. Un esempio di questo tipo è il diamante, una macromolecola formata da numerosi atomi di carbonio in una rete covalente.
Legame covalente
Un legame chimico covalente si stabilisce tra due atomi quando condividono la loro elettroni più esterno (di valenza). Le molecole possono avere due tipi di legami:
Legame covalente molecolare: la coppia di elettroni dei due atomi di legame è condivisa.

Legame covalente covalente (dativo): gli elettroni condivisi provengono da uno solo degli atomi coinvolti.

Geometria Molecolare
Quando si forma una molecola, gli atomi vengono posizionati in modi diversi, in modo che la disposizione spaziale sia più stabile. Pertanto, i compositi hanno geometrie diverse.
Ecco alcune delle geometrie che possono avere le molecole.
| Geometria Molecolare | ||
|---|---|---|
| Lineare | Angolare | Triangolare |
 |
 |
 |
| Piramidale | tetraedrico | ottaedrico |
 |
 |
 |
Molecole polari e non polari
Le molecole sono classificate secondo il polarità.
molecole non polari: non c'è differenza di elettronegatività tra gli atomi.
| Azoto (N2) | anidride carbonica (CO2) |
|---|---|
 |
 |
Azoto (N2) è una molecola non polare perché è formata da essa elemento chimico e quindi non c'è differenza di elettronegatività. anidride carbonica (CO2) è apolare grazie alla sua geometria lineare, che stabilizza l'attrazione dell'ossigeno da parte degli elettroni.
molecole polari: esiste una differenza di elettronegatività tra gli atomi, con polo positivo e polo negativo.
| Acqua (H2o) | ammoniaca (NH3) |
|---|---|
 |
 |
In entrambi gli esempi, vediamo che gli atomi centrali, ossigeno e azoto, hanno coppie di elettroni spaiate che formano nuvole di elettroni. Poiché ci sono più nuvole elettroniche attorno agli atomi centrali di quanti siano i legami chimici stabiliti, le molecole sono polari.
Esempi di molecole
| Sostanza | Caratteristiche | Molecola | Formula |
|---|---|---|---|
| Idrogeno | Carburante e abbondante nella crosta terrestre. |  |
H2 |
| Ossigeno | Essenziale per la respirazione e partecipa a varie reazioni chimiche |  |
oh2 |
| Zolfo | Polvere gialla usata per fare i coloranti. |  |
S8 |
| Diossido di carbonio | Utilizzato in estintori e refrigeranti. |  |
CO2 |
| etanolo | Alcool comune usato come combustibile e nei profumi. |  |
Ç2H6oh |
Assicurati di dare un'occhiata a questi testi su argomenti relativi a ciò che hai appena imparato:
- Biomolecole
- Composti organici
- Massa molecolare
- Regola dell'ottetto
- Legami chimici
- Polarità di connessione
- Forze intermolecolari