I modelli atomici sono emersi dalla necessità di spiegare la struttura degli atomi. Quando sono state presentate nuove prove sulla costituzione degli atomi, un nuovo modello atomico ha cercato di chiarire i risultati.
I filosofi greci Democrito e Leucipo nel V secolo;. chiamato atomo, dal greco ατoμoν, la particella indivisibile e la parte più piccola della materia.
Sebbene il concetto di atomo sia antico, lo sviluppo delle teorie atomiche risale al XIX e XX secolo. Pertanto, i principali modelli atomici sviluppati per comprendere la natura della materia sono stati:
- Modello atomico di Dalton (1803) - "Modello di palla da biliardo"
- Modello atomico Thomson (1898) - "Modello di budino di pioggia"
- Modello atomico di Rutherford (1911) - "Modello nucleare"
- Modello atomico di Bohr (1913) - "Modello planetario"
- Modello atomico quantistico (1926) - "Modello di nuvola elettronica"

Il modello atomico di Dalton
Il primo tentativo riconosciuto di descrivere gli atomi venne dallo scienziato inglese John Dalton (1766-1844) in un modello che divenne popolarmente noto come "palla da biliardo".
Atomo di Dalton (1803): sfera massiccia, indivisibile e indistruttibile.

Secondo Dalton:
- Tutte le sostanze sono formate da atomi;
- Gli atomi di un elemento chimico sono identici per dimensioni e caratteristiche, mentre quelli di elementi chimici diversi sono diversi;
- Le sostanze sono il risultato di una reazione chimica, che consiste nella ricombinazione di atomi.
Punti negativi: Poiché gli elettroni non erano ancora conosciuti quando Dalton ha formulato la sua teoria, queste particelle, che ora sappiamo essere parte degli atomi, non sono state considerate.
Impara di più riguardo Il modello atomico di Dalton.
Modello atomico Thomson
Joseph John Thomson (1856-1940) fu responsabile della scoperta dell'esistenza degli elettroni, particelle dotate di carica negativa e che fanno parte degli atomi. Questa scoperta capovolse la teoria atomica di Dalton, secondo cui l'atomo è indivisibile, ma formato da particelle ancora più piccole e, quindi, divenne noto come "budino all'uvetta".
L'atomo di Thomson (1898): sfera carica positivamente con elettroni fissi.

Secondo Thomson:
- L'atomo è elettricamente neutro;
- Gli elettroni si attaccano a una superficie carica positivamente;
- C'è una repulsione tra gli elettroni distribuiti negli atomi.
Punti negativi: Sebbene Thomson tenesse conto dell'esistenza degli elettroni, l'atomo non è una sfera positiva, ma piuttosto dotato di particelle cariche positivamente, i protoni, identificati nel 1886 dallo scienziato Eugene Goldstein e successivamente confermati da Ernest Rutherford.
Impara di più riguardo Modello atomico Thomson.
Modello atomico di Rutherford
Attraverso i suoi esperimenti Ernest Rutherford (1871-1937) riuscì a dimostrare che l'atomo non era una particella indivisibile come si credeva, ma che era formato da particelle più piccole.
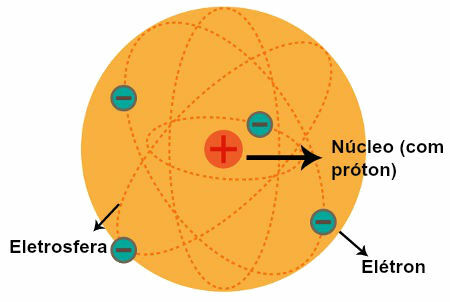
L'atomo di Rutherford (1911): nucleo ed elettroni carichi positivamente si trovano attorno ad esso nell'elettrosfera.

Secondo Rutherford:
- L'atomo ha una regione centrale con un'alta concentrazione di carica positiva;
- La massa di un atomo è concentrata nella sua regione centrale;
- Gli elettroni sono più leggeri e si trovano intorno al nucleo, una regione che contiene molti spazi vuoti.
Punti negativi: Il nucleo atomico non ha solo particelle cariche positivamente, ma ci sono anche altre particelle subatomiche, i neutroni, scoperte da James Chadwick nel 1932. Inoltre, il modello proposto da Rutherford non spiegava l'emissione di luce da parte degli atomi.
Impara di più riguardo Modello atomico di Rutherford.
Il modello atomico di Bohr
Cercando di spiegare perché gli elementi emettono colori caratteristici quando esposti ad alcune condizioni e in base al Il modello atomico di Rutherford, Niels Bohr (1885-1962) propose una teoria atomica che spiegava l'emissione di luce in alcuni frequenze.
L'atomo di Bohr (1913): gli elettroni si muovono in strati circolari fissi attorno al nucleo.

Secondo Bohr:
- Gli elettroni si muovono negli strati attorno al nucleo;
- Gli strati attorno al nucleo hanno valori energetici specifici;
- Per andare a un livello più esterno l'elettrone deve assorbire energia. Tornando in uno strato più vicino al nucleo, l'elettrone rilascia energia.
Punti negativi: Non si può dire che gli elettroni viaggino intorno al nucleo in posizioni fisse come i pianeti intorno al Sole.
Impara di più riguardo Modello atomico di Bohr.
Modello atomico quantistico
Molti scienziati hanno contribuito allo sviluppo della meccanica quantistica, che cerca di spiegare la struttura "più reale" di a atomo dalla combinazione di più studi e, quindi, è il più complesso.
Atomo quantistico (1926): il nucleo è formato da protoni (carica positiva) e neutroni (carica zero), mentre gli elettroni (carica negativa) formano una nuvola elettronica attorno al nucleo.

Secondo il modello atomico quantistico:
- Il nucleo è formato da protoni e neutroni. Poiché solo i protoni hanno una carica, il nucleo è caricato positivamente;
- Gli elettroni formano una nuvola elettronica attorno al nucleo;
- Gli elettroni si muovono negli orbitali, nello spazio tridimensionale;
- La posizione esatta di un elettrone non può essere definita. Ciò che viene fatto sono calcoli che determinano la probabilità della regione in cui si troverà un elettrone in un dato momento.
voi numeri quantici hanno la funzione di localizzare gli elettroni. Sono loro:
oh numero quantico principale (n) rappresenta i livelli energetici, cioè gli strati elettronici di un atomo.
oh numero quantico secondario (l) indica i sottolivelli energetici, cioè il sottolivello energetico a cui appartiene l'elettrone.
oh numero quantico magnetico (m) è quella che indica l'orbita dove si incontrano gli elettroni.
Impara di più riguardo modelli atomici e metti alla prova le tue conoscenze con esercizi sui modelli atomici.