La tavola periodica è un importante strumento di studio che raccoglie informazioni su tutti gli elementi chimici conosciuti.
Metti alla prova le tue conoscenze con questo elenco di 17 domande con i diversi approcci sull'argomento e risolvi i tuoi dubbi con le risoluzioni commentate dopo il feedback.
Per aiutare a capire le domande, usa il tavola periodica completo e aggiornato.
Organizzazione della tavola periodica
domanda 1
(UFU) All'inizio del XIX secolo, con la scoperta e l'isolamento di alcuni elementi chimici, si è reso necessario classificarli razionalmente, al fine di effettuare studi sistematici. Molti contributi sono stati aggiunti fino a raggiungere l'attuale classificazione periodica degli elementi chimici. Per quanto riguarda l'attuale classificazione periodica, rispondere:
a) Come sono elencati in sequenza gli elementi nella tavola periodica?
La tavola periodica è organizzata in sequenze di elementi chimici in ordine crescente di numero atomico. Questo numero corrisponde al numero di protoni nel nucleo dell'atomo.
Questo metodo di organizzazione è stato proposto da Henry Moseley quando ha riconfigurato la tabella proposta da Dmitri Mendeleiev.
Un elemento può essere localizzato nella tabella in base alla famiglia e al periodo in cui è inserito. Questa distribuzione avviene come segue:
| gruppi o famiglie | 18 sequenze verticali |
| Gruppi di elementi che hanno caratteristiche simili. |
| periodi | 7 sequenze orizzontali |
| Numero di strati elettronici di cui dispone l'elemento. |
b) Quali gruppi nella tavola periodica si possono trovare: un alogeno, un metallo alcalino, un metallo alcalino terroso, un calcogeno e un gas nobile?
La classificazione degli elementi in gruppi avviene in base alle proprietà. Gli elementi che sono nello stesso gruppo hanno caratteristiche simili e per le classificazioni fornite dobbiamo:
| Classificazione | Gruppo | Famiglia | Elementi |
| alogena | 17 | 7A | F, Cl, Br, I, A e Ts |
| metallo alcalino | 1 | 1A | Li, Na, K, Rb, Cs e Fr |
| metallo alcalino-terroso | 2 | 2A | Be, Mg, Ca, Sr, Ba e Ra |
| calcogeno | 16 | 6A | O, S, Se, Te, Po e Lv |
| gas nobile | 18 | 8A | He, Ne, Ar, Kr, Xe, Rn e Og |
Domanda 2
(PUC-SP) Risolvere il problema in base all'analisi delle dichiarazioni di seguito.
I – L'attuale tavola periodica moderna è organizzata in ordine crescente di massa atomica.
II - Tutti gli elementi che hanno 1 elettrone e 2 elettroni nel guscio di valenza sono, rispettivamente, metalli alcalini e metalli alcalino-terrosi, a condizione che il numero quantico principale di questo strato (n 1).
III – Nello stesso periodo gli elementi presentano lo stesso numero di livelli (strati).
IV – Nello stesso gruppo (famiglia), gli elementi hanno lo stesso numero di livelli (livelli).
Si conclude che, rispetto all'attuale tavola periodica degli elementi chimici, sono corretti:
a) I e IV (solo).
b) I e II (solo).
c) II e III (solo).
d) II e IV (solo).
e) III e IV (solo).
Alternativa corretta: c) II e III (solo).
Analizzando ogni alternativa dobbiamo:
IO – SBAGLIATO. Gli elementi sono disposti in ordine crescente di numero atomico.
II – CORRETTO. Gli elettroni nel guscio di valenza definiscono il gruppo in cui si trova l'elemento.
| metalli alcalini | 1 elettrone nel guscio di valenza |
| 3leggere | 2-1 |
| 11A | 2-8-1 |
| 19K | 2-8-8-1 |
| 37Rb | 2-8-18-8-1 |
| 55Cs | 2-8-18-18-8-1 |
| 87Fr | 2-8-18-32-18-8-1 |
| metalli alcalino-terrosi | 2 elettroni nel guscio di valenza |
| 4essere | 2-2 |
| 12mg | 2-8-2 |
| 20Qui | 2-8-8-2 |
| 38Sig | 2-8-18-8-2 |
| 56Ba | 2-8-18-18-8-2 |
| 88Rana | 2-8-18-32-18-8-2 |
Il numero quantico principale corrisponde al guscio in cui si trova l'elettrone, essendo diverso da 1 perché dalla distribuzione elettronica notiamo che la posizione dell'elettrone è dal secondo guscio o n=2.
III – CORRETTO. La posizione di un elemento in un determinato periodo è dovuta al numero di strati quando si effettua la distribuzione elettronica.
| periodi | 7 sequenze orizzontali |
| 1° periodo | 1 strato: K |
| 2° periodo | 2 strati: K, L |
| 3° periodo | 3 strati: K, L, M |
| 4° periodo | 4 strati: K, L, M, N |
| 5° periodo | 5 strati: K, L, M, N, O |
| 6° periodo | 6 strati: K, L, M, N, O, P |
| 7° periodo | 7 strati: K, L, M, N, O, P, Q |
Esempio: elemento chimico situato nel secondo periodo.
IV – SBAGLIATO. Elementi appartenenti allo stesso gruppo hanno caratteristiche simili e questo è dovuto al fatto che hanno lo stesso numero di elettroni nel guscio di valenza.
Esempio:
| Berillio | Magnesio |
|
2 elettroni in strato di valenza. |
2 elettroni in strato di valenza. |
Pertanto, berillio e magnesio fanno parte del gruppo 2 della tavola periodica.
Domanda 3
(Unità) Per quanto riguarda la moderna classificazione periodica degli elementi, identificare la vera affermazione:
a) in una famiglia, gli elementi hanno generalmente lo stesso numero di elettroni nell'ultimo guscio.
b) sulla tavola periodica, gli elementi chimici sono posti in ordine decrescente di massa atomica.
c) in una famiglia gli elementi hanno proprietà chimiche molto diverse.
d) in un periodo, gli elementi hanno proprietà chimiche simili.
e) tutti gli elementi rappresentativi appartengono al gruppo B della tavola periodica.
Alternativa corretta: a) in una famiglia, gli elementi hanno generalmente lo stesso numero di elettroni nell'ultimo guscio.
a) CORRETTO. Gli elementi chimici della stessa famiglia hanno lo stesso numero di elettroni nell'ultimo guscio e questo li fa avere caratteristiche simili.
b) SBAGLIATO. Le masse atomiche aumentano all'aumentare del numero atomico dell'elemento.
c) SBAGLIATO. Le proprietà chimiche degli elementi sono simili, quindi sono raggruppati nella stessa famiglia.
d) SBAGLIATO. Un tempo, gli elementi hanno i loro elettroni distribuiti nello stesso numero di gusci.
e) SBAGLIATO. Gli elementi rappresentativi appartengono al gruppo A, che corrisponde alle famiglie: 1A, 2A, 3A, 4A, 5A, 6A, 7A e 8A. Gli elementi che appartengono al gruppo B sono elementi di transizione.
domanda 4
(Vunesp) Considerando le proprietà degli elementi chimici e della tavola periodica, non è corretto affermare:
a) un metallo è una sostanza che conduce corrente elettrica, è duttile e malleabile.
b) un non metallo è una sostanza che non conduce corrente elettrica, non è né duttile né malleabile.
c) un semimetallo ha l'aspetto fisico di un metallo, ma un comportamento chimico simile a quello di un non metallo.
d) la maggior parte degli elementi chimici è costituita da non metalli.
e) i gas nobili sono monoatomici.
Alternativa errata: d) la maggior parte degli elementi chimici sono non metalli.
Nota la classificazione degli elementi chimici sulla tavola periodica in metalli, non metalli e semimetalli.

Come possiamo vedere, la maggior parte degli elementi sono metalli.
a) CORRETTO. I metalli conducono elettricità a causa delle nuvole di elettroni formate da elettroni liberi, che sono caratteristici della loro struttura. Sono duttili perché possono trasformarsi in fili o fogli, a seconda della regione in cui viene applicata la pressione. Sono inoltre malleabili, in quanto con questo tipo di materiale si possono produrre lastre molto sottili.
b) CORRETTO. I non metalli hanno le caratteristiche opposte dei metalli. Al posto dei conduttori, sono buoni isolanti termici e, essendo fragili, non vengono stampati in fili o lastre in quanto non hanno una buona duttilità e malleabilità.
c) CORRETTO. I semimetalli hanno caratteristiche intermedie ai metalli e ai non metalli. Essendo semiconduttori di elettricità, hanno una lucentezza metallica ma sono fragili come i non metalli.
d) SBAGLIATO. La maggior parte degli elementi sono classificati come metalli. Le classi di metalli presenti nella tavola periodica sono: alcalino, alcalino terroso, di transizione interno ed esterno.
e) CORRETTO. I gas nobili sono monoatomici, quindi sono rappresentati solo dalle loro iniziali.
Esempio:
| gas nobile | calcogeno |
| Elio (Lui) | Ossigeno (O2) |
| monoatomico: formato da un atomo | biatomico: formato da due atomi |
A causa della stabilità dei gas nobili, gli elementi di questa famiglia hanno una bassa reattività e sono anche detti inerti.
domanda 5
Riguardo all'organizzazione dell'attuale tavola periodica, rispondi:
a) Cosa sono le colonne?
b) Quali sono le linee?
c) Qual è il metodo utilizzato per organizzare gli elementi chimici?
Risposte:
a) le colonne sono i gruppi della Tavola Periodica, anticamente chiamati famiglie, che riuniscono elementi chimici con proprietà simili.
b) Le linee sono i periodi della Tavola Periodica e indicano il numero di strati elettronici di un atomo nello stato fondamentale.
c) Gli elementi chimici nell'attuale Tavola Periodica sono disposti in ordine crescente di numero atomico, che indica il numero di protoni nel nucleo dell'atomo.
Famiglie della tavola periodica
domanda 1
(CESGRANRIO) Effettuando l'associazione tra le colonne sottostanti, che corrispondono alle famiglie di elementi secondo la tavola periodica, la sequenza numerica sarà:
| 1. gas nobili | • Gruppo 1A |
| 2. metalli alcalini | • Gruppo 2A |
| 3. metalli alcalino-terrosi | • Gruppo 6A |
| 4. Calcogeni | • Gruppo 7A |
| 5. Alogeni | • Gruppo 0 |
a) 1, 2, 3, 4, 5.
b) 2, 3, 4, 5, 1.
c) 3, 2, 5, 4, 1.
d) 3, 2, 4, 5, 1.
e) 5, 2, 4, 3, 1.
Alternativa corretta: b) 2, 3, 4, 5, 1.
| gruppi | configurazione elettronica |
| • Gruppo 1A: 2. metalli alcalini | noi1 (con n |
| • Gruppo 2A: 3. metalli alcalino-terrosi | noi2 (con n |
| • Gruppo 6A: 4. Calcogeni | noi2np4 |
| • Gruppo 7A: 5. Alogeni | noi2np5 |
| • Gruppo 0: 1. gas nobili | 1s2 (Lui) o noi2np6 (se n > 1) |
Domanda 2
(UECE) L'elemento chimico con Z = 54 ha la configurazione 5s nel suo strato di valenza2 5p6. Gli elementi con Z = 52 e con Z = 56 appartengono alle famiglie di:
a) calcogeni e terre alcaline
b) alogeni e alcali
c) alogeni e terre alcaline
d) calcogeni e alcali
Alternativa corretta: a) calcogeni e terre alcaline.
Dati i numeri atomici, abbiamo eseguito la distribuzione elettronica e abbiamo trovato i seguenti risultati:
| 54X e | 52voi | 56Ba |
|
8 elettroni in strato di valenza |
6 elettroni in strato di valenza |
2 elettroni in strato di valenza |
| Gas Nobili: famiglia 8A | Calcogeni: famiglia 6A | Terra alcalina: famiglia 2A |
Domanda 3
(F. Ibero-Americana-SP) Il gruppo della Tavola Periodica che si caratterizza per la predominanza di elementi artificiali è il seguente:
a) lantanidi
b) gas nobili
c) metalli di transizione
d) metalli alcalino-terrosi
e) attinidi
Alternativa corretta: e) attinidi.
Gli elementi artificiali sono quelli che non esistono in natura e che sono stati sintetizzati in laboratorio attraverso reazioni nucleari.
Sono anche chiamati elementi transuranici, in quanto questi elementi radioattivi hanno un numero atomico maggiore di 92, che corrisponde all'uranio.
In generale, questi elementi sono di breve durata, della durata di frazioni di secondo.
In base a queste informazioni dobbiamo:
Gli elementi presenti in natura sono: lantanidi, gas nobili, metalli di transizione e metalli alcalino-terrosi. Ad eccezione del tecnezio e del promezio, che sono artificiali.
La predominanza degli elementi artificiali sono gli attinidi, classificati come metalli di transizione interna e inseriti nella tavola periodica al di sotto dei lantanidi. Da quella serie, solo attinio, torio, protattinio e uranio sono naturali.
domanda 4
(U. Chiesa Cattolica di Salvador-BA) La X specie2- con 8 elettroni nel guscio più esterno (guscio di valenza) può provenire dall'elemento X, che, nella Tavola Periodica, appartiene al gruppo:
a) 7A
b) 6A
c) 2A
d) 1A
e) 8A
Alternativa corretta: b) 6A.
Secondo la regola dell'ottetto, un elemento per acquisire stabilità assume la configurazione elettronica di un gas nobile, che ha 8 elettroni nel guscio di valenza.
Carica 2- sulla specie X2- indica che l'elemento ha guadagnato 2 elettroni.
La configurazione elettronica della specie con 8 elettroni nel guscio più esterno è ns2np6.
Dopo aver perso due elettroni, l'elemento ritorna al suo stato fondamentale con ns configurazione elettronica2np4.
I 6 elettroni nel guscio di valenza sono caratteristici dei calcogeni, elementi della famiglia 6A.
Per esempio:
| Elemento: ossigeno | configurazione elettronica |
| 8oh | 1s22s22p4 |
| specie O2- | 1s22s22p6 |
Impara di più riguardo Famiglie della tavola periodica.
Elementi chimici
domanda 1
(CESGRANRIO) Dati gli elementi dei numeri atomici 3, 9, 11, 12, 20, 37, 38, 47, 55, 56 e 75, l'opzione che contiene solo metalli alcalini è:
a) 3, 11, 37 e 55
b) 3, 9, 37 e 55
c) 9, 11, 38 e 55
d) 12, 20, 38 e 56
e) 12, 37, 47 e 75
Alternativa corretta: a) 3, 11, 37 e 55
I metalli alcalini corrispondono agli elementi chimici che terminano la distribuzione elettronica con un elettrone nel sottolivello s.
Facendo la distribuzione elettronica dei numeri atomici dati, abbiamo i seguenti metalli alcalini:
| Z = 3 | Z = 11 | Z = 37 | Z = 55 |
| Litio | Sodio | Rubidio | Cesio |
Gli altri numeri atomici corrispondono a elementi dei seguenti gruppi:
Metalli alcalino terrosi: terminare la distribuzione elettronica al sottolivello s2.
| Z = 12 | Z = 38 | Z = 56 |
| Magnesio | Stronzio | Bario |
Metalli di transizione: terminare la distribuzione elettronica al livello inferiore d.
| Z = 30 | Z = 47 | Z = 75 |
| Zinco | Argento | renio |
Alogeni: terminare la distribuzione elettronica al sottolivello p5.
| Z = 9 |
Domanda 2
(Unirio) “Il cuore artificiale posizionato in Eloi ha iniziato a svilupparsi quattro anni fa negli Stati Uniti ed è già utilizzato da circa 500 persone. Il set, chiamato Heartmate, è composto da tre pezzi principali. La più importante è una borsa rotonda da quattro libbre, 12 centimetri di diametro e 3 centimetri di spessore, realizzata in titanio, un metallo bianco-argento, leggero e resistente. Rivista Veja, luglio 1999.
Tra i metalli sottostanti, quello che ha, nell'ultimo strato, un numero di elettroni pari a quello del titanio è:
AC
bidone
c) Ga
d) mg
EXE
Alternativa corretta: d) Mg.
| Titanio | configurazione elettronica | Distribuzione dei livelli |
| 22voi | 1s2 2s2 2p6 3s2 3p6 4s2 3d2 | 2, 8, 10, 2 |
Dalla distribuzione elettronica del titanio, vediamo che questo elemento ha 2 elettroni nell'ultimo guscio.
| Elemento | configurazione elettronica | Distribuzione dei livelli |
| 6Ç | 1s2 2s2 2p2 | 2, 4 |
| 11A | 1s2 2s2 2p6 3s1 | 2, 8, 1 |
| 31Ga | 1s2 2s2 2p6 3s2 3p6 4s2 3d104p1 | 2, 8, 18, 3 |
| 12mg | 1s2 2s2 2p6 3s2 | 2, 8, 2 |
| 54X e | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p6 | 2, 8, 18, 18, 8 |
L'elemento che ha anche 2 elettroni nell'ultimo guscio è il magnesio.
Domanda 3
(UFPA) Considera un certo elemento chimico il cui sottolivello più energetico è 5s2. Il suo numero atomico e il gruppo in cui si trova sulla tavola periodica sono, rispettivamente:
a) 20; 1A
b) 20; 2A
c) 38; 2A
d) 38; 1A
e) 39; 2A
Alternativa corretta: c) 38; 2A
Facendo la distribuzione elettronica, abbiamo scoperto che:
- L'elemento chimico si trova nella famiglia 2A, poiché ha il sottolivello più energetico il s2
- Ha numero atomico 38, che corrisponde al numero totale di elettroni distribuiti.
- Si colloca nel quinto periodo, in quanto la distribuzione elettronica è stata effettuata fino al quinto strato.
Controllando queste informazioni nella tavola periodica, possiamo confermare che si tratta dell'elemento stronzio.
domanda 4
(UFC) Un atomo x ha un protone in più di un atomo y. Sulla base di queste informazioni, determinare l'affermazione corretta.
a) Se y è alcalino terroso, x è metallo alcalino.
b) Se y è un gas nobile, x è un alogeno.
c) Se y è un metallo di transizione, x è un gas nobile.
d) Se y è un gas nobile, x è un metallo alcalino.
e) x si trova nello stesso periodo prima dell'atomo y nella tavola periodica.
Alternativa corretta: d) Se y è un gas nobile, x è un metallo alcalino.
La tavola periodica è organizzata in ordine crescente di numero atomico.
Se Y ha numero atomico z e X ha un protone in più, significa che questi due elementi sono nello stesso periodo e X è successivo a Y.
Esempio:
| Elemento | elemento successivo |
| zsì | z + 1X |
| 11A | 12mg |
I due elementi sono nel 3° periodo e il magnesio ha un protone in più del sodio.
Secondo questo ragionamento dobbiamo:
a) SBAGLIATO. Un metallo alcalino viene prima di un metallo alcalino-terroso nella tavola periodica. L'affermazione corretta sarebbe: se y è un metallo alcalino, x è alcalino-terroso.
b) SBAGLIATO. Un alogeno viene prima del gas nobile sulla tavola periodica. L'affermazione corretta sarebbe: se y è alogeno, x è un gas nobile.
c) SBAGLIATO. I metalli di transizione e i gas nobili sono separati da altri elementi chimici e quindi non sono sequenziali.
d) CORRETTO. I gas nobili sono l'ultimo gruppo della tavola periodica e i metalli alcalini il primo, quindi sono sequenziali.
Esempio:
| gas nobile | metallo alcalino |
| zsì | z + 1X |
| 2lui | 3leggere |
Il litio, un metallo alcalino, ha un protone in più dell'elio, che è un gas nobile.
e) SBAGLIATO. X è nello stesso periodo di Y ma dopo di esso, non prima degli stati alternativi.
domanda 5
Dal numero atomico di un elemento chimico è possibile conoscere:
a) il numero di neutroni nel nucleo
b) il numero di elettroni nell'elettrosfera
c) la massa del nucleo
Risposta: b) il numero di elettroni nell'elettrosfera
Un atomo allo stato fondamentale è elettricamente neutro. Quindi, conoscendo il numero atomico, che corrisponde al numero di protoni (particelle caricate positivamente), conosciamo il numero di elettroni (particelle caricate negativamente) nell'elettrosfera.
Ad esempio, il ferro ha numero atomico 26, quindi nello stato fondamentale ha 26 elettroni attorno al nucleo.
Impara di più riguardo elementi chimici è il numero atomico.
Proprietà periodiche e aperiodiche
domanda 1
(UFSM) Giudicare se le affermazioni relative alle proprietà periodiche degli elementi sono vere (T) o false (F).
( ) Dipende dalle masse atomiche degli elementi.
( ) Si ripetono ad intervalli più o meno regolari in relazione all'aumento dei numeri atomici.
( ) Sono simili nello stesso gruppo di elementi.
( ) Sono simili nello stesso periodo di elementi.
( ) Nello stesso gruppo, i valori numerici delle proprietà periodiche aumentano sempre quando c'è un aumento del numero atomico degli elementi.
La sequenza corretta è:
a) V - F - V - F - F
b) V - F - F - V - V
c) F - V - V - F - F
d) F - V - F - V - V
e) V - F - F - V - F
Alternativa corretta: c) F - V - V - F - F
(FALSO) Dipende dalle masse atomiche degli elementi.
Secondo la legge della periodicità di Moseley, molte proprietà fisiche e chimiche degli elementi chimici variano in base al numero atomico.
(VERO) Si ripetono ad intervalli più o meno regolari in relazione all'aumento dei numeri atomici.
Proprietà come raggio atomico, volume atomico, densità, punto di fusione e ebollizione sono esempi di proprietà che ricorrono regolarmente nella tavola periodica.
(VERO) Sono simili nello stesso gruppo di elementi.
I gruppi della tavola periodica sono stati organizzati con elementi che hanno proprietà simili.
(FALSO) Sono simili nello stesso periodo di elementi.
Le proprietà sono simili nelle famiglie, non nei periodi. In periodi, gli elementi sono distribuiti per il numero di strati elettronici.
(FALSO) Nello stesso gruppo, i valori numerici delle proprietà periodiche aumentano sempre quando c'è un aumento del numero atomico degli elementi.
Le proprietà possono aumentare o diminuire a seconda del numero atomico. Un esempio di ciò è l'elettronegatività, che diminuisce all'aumentare del numero atomico in un dato gruppo.
Leggi anche: Proprietà periodiche
Domanda 2
(FAESP) Le proprietà aperiodiche degli elementi sono:
a) densità, volume atomico e massa atomica.
b) punto di fusione, elettronegatività e calore specifico.
c) volume atomico, massa atomica e punto di fusione.
d) massa atomica, calore specifico e punto di fusione.
e) massa atomica e calore specifico.
Alternativa corretta: e) massa atomica e calore specifico.
Le proprietà aperiodiche si ripetono ad intervalli regolari.
La massa atomica è la misura del peso dell'atomo in unità di massa atomica, che corrisponde a della massa del carbonio-12.
Il calore specifico determina la quantità di calore necessaria per aumentare la temperatura di 1 °C di 1 g dell'elemento.
Queste due proprietà non sono correlate alla posizione dell'elemento sulla tavola periodica.
Le altre proprietà sono classificate come periodiche in quanto aumentano o diminuiscono con il numero atomico. Sono loro:
- Densità: rappresenta il quoziente tra la massa e il volume di un elemento.
- Volume atomico: rappresenta il volume di un insieme di atomi e influenza la distanza tra loro.
- Punto di fusione: temperatura alla quale avviene il passaggio da solido a liquido.
- Elettronegatività: capacità dell'atomo di attrarre a sé la coppia elettronica che condivide in un legame covalente.
Leggi anche: elettronegatività e Affinità elettronica
Domanda 3
(PUC-PR) Tra i seguenti diagrammi relativi alla tavola periodica, quali sono corretti?
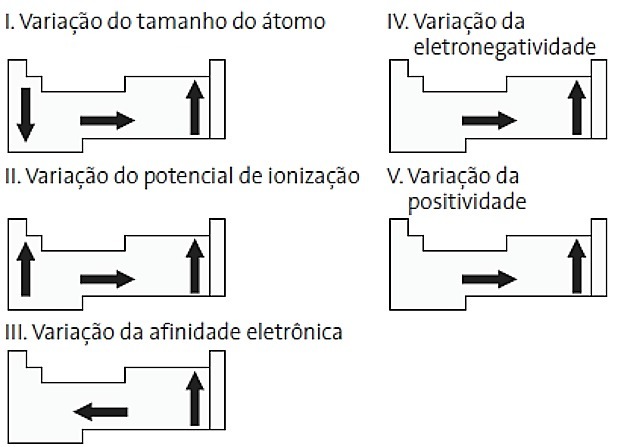
a) II e V
b) II e III
c) I e V
d) II e IV
e) III e IV
Alternativa corretta: d) II e IV.
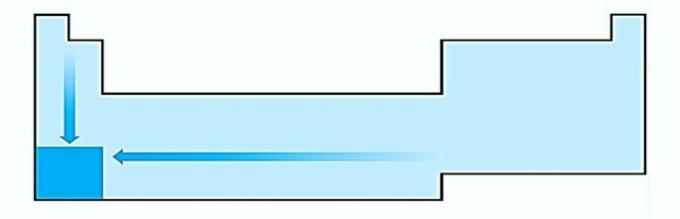
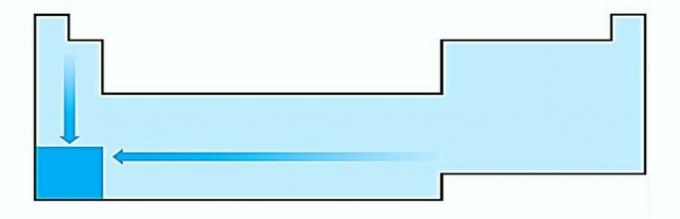
IO. SBAGLIATO. La variazione della dimensione dell'atomo è misurata dalla distanza media dal nucleo all'elettrone più esterno. Gli atomi più grandi si trovano nella parte inferiore della tabella, quindi l'aumento avviene in base al numero atomico e la rappresentazione corretta è:
II. CORRETTA L'energia necessaria per strappare un elettrone da un atomo isolato allo stato gassoso è chiamata potenziale di ionizzazione. Aumenta come mostrato nel diagramma delle istruzioni.
III. SBAGLIATO. L'affinità elettronica esprime l'energia rilasciata quando un atomo neutro allo stato gassoso riceve un elettrone, che è una proprietà molto importante dei non metalli. Le più alte affinità elettroniche si osservano negli alogeni e nell'ossigeno.
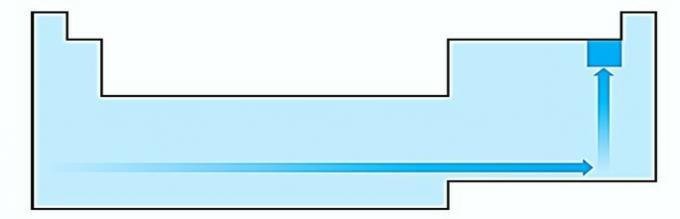
IV. CORRETTA L'elettronegatività è correlata al potenziale di ionizzazione e all'affinità elettronica. In quanto tali, gli alogeni sono gli elementi più elettronegativi della tavola periodica.
v. SBAGLIATO. L'elettropositività si verifica nella direzione opposta all'elettronegatività. Rappresenta la capacità dell'atomo di cedere elettroni.
Pertanto, i metalli alcalini hanno la più alta elettropositività.
Continua a testare le tue conoscenze con gli elenchi:
- Esercizi sui legami chimici
- Esercizi sulla distribuzione elettronica
- Esercizi sui modelli atomici
- Esercizi di termochimica

