Una sostanza pura è formata da un singolo tipo di specie chimica, cioè la sua composizione e le sue proprietà sono fisse. Un mix contiene più di un tipo di componente, quindi la sua organizzazione varia.
Pertanto, possiamo distinguere una sostanza pura da una miscela solo quando ne conosciamo la composizione.
Confrontando un bicchiere d'acqua e un bicchiere di zucchero disciolto, i nostri occhi non notano alcuna differenza. Tuttavia, se ingeriamo il contenuto dei due bicchieri noteremo che uno è la sostanza pura e l'altro è costituito da una miscela.
sostanze pure
Una sostanza pura è l'insieme di una sola specie chimica, cioè non è mischiata con altre.
Usiamo l'acqua come esempio. L'acqua (H2O) è riconosciuto per le sue caratteristiche e le proprietà specifiche di questo materiale ci aiutano ad identificarlo. Il principale proprietà dell'acqua sono:
| Densità | 1,00 g/cm3 |
|---|---|
| Punto di fusione | 0°C |
| Punto di ebollizione | 100°C |
Quando un materiale ha proprietà fisse e invariabili nella sua interezza, si dice che è a sostanza pura.
Quando mettiamo il sale da cucina, il cloruro di sodio (NaCl), in un bicchiere d'acqua e mescoliamo, si verificherà un cambiamento.

Il risultato è un prodotto con una densità intermedia tra quella dell'acqua e quella del sale. Questo perché l'acqua non è più una sostanza pura ed è diventata una Mescolare.
Quando provi a congelare questa miscela, noterai che la temperatura di fusione sarà inferiore a 0 °C e che anche questa miscela non bollirà a 100 °C, servirà più calore per farlo evaporare Prodotto.
Sostanze pure semplici e composte
Le sostanze pure sono classificate come semplici quando nella loro composizione sono presenti atomi di un solo elemento chimico.
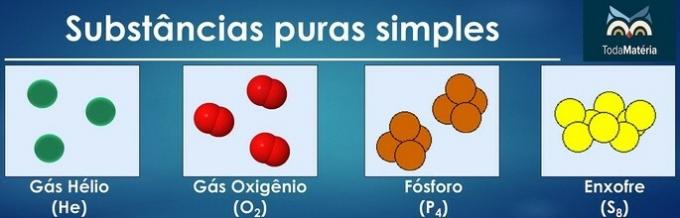
La disposizione degli atomi di due o più elementi chimici forma sostanze composite pure.

miscele
Una miscela corrisponde all'unione di due o più sostanze pure, che vengono chiamate componenti.
A differenza delle sostanze pure, le sue proprietà non sono fisse poiché dipendono dalla proporzione dei componenti nella miscela.
Guarda come la densità, una proprietà fisica, varia con la quantità di sale mescolata con l'acqua.
| Percentuale di sale in massa totale della miscela |
Densità della miscela (g/cm3) a 20 °C |
|---|---|
| 1 | 1,005 |
| 8 | 1,056 |
| 12 | 1,086 |
| 16 | 1,116 |
| 26 | 1,197 |
Fonte: FURNISS, B. S. et al. Libro di testo di Vogel's di chimica organica pratica. 4. ed. Londra: Longman, 1987. p. 1.312.
Pertanto, l'aggiunta di acqua e sale, in qualsiasi proporzione, ha una densità variabile e, quindi, non possiamo classificare la miscela né come acqua né come sale.
Miscele omogenee ed eterogenee
Le miscele omogenee sono quelle che presentano i componenti in una sola fase e, quindi, le stesse proprietà in tutti i punti.

Quando percepiamo visivamente più di una fase, la miscela viene classificata come eterogenea.

Riepilogo su sostanze e miscele pure
| Sostanze e miscele pure | |
|---|---|
|
sistema omogeneo (una sola fase) |
sostanza pura (un componente) |
|
miscela omogenea homogeneous (più di un componente nella stessa fase) | |
|
sistema eterogeneo (più di una fase) |
sostanza pura (un componente in diversi stati fisici) |
|
miscela eterogenea (più di un componente in più di una fase) |
Per saperne di più, assicurati di controllare questi testi:
- Atomi
- Elementi chimici
- Separazione di miscele
Esercizi con feedback commentato
1. (UFMG) Ad un campione di una sostanza X pura sono state determinate alcune delle sue proprietà. Tutte le alternative hanno proprietà utili per identificare questa sostanza, eccetto:
a) densità.
b) massa del campione.
c) solubilità in acqua.
d) temperatura di ebollizione.
e) temperatura di fusione.
Alternativa sbagliata: b) massa del campione.
a) CORRETTO. La densità è la quantità di materia in un dato volume. In quanto proprietà specifica del materiale, è utile per identificare una sostanza.
b) SBAGLIATO. La massa è la quantità di materia in un corpo. Poiché questa proprietà si applica a qualsiasi materia, indipendentemente dalla sua costituzione, non è possibile utilizzarla per identificare una sostanza.
c) CORRETTO. La solubilità è la capacità di una sostanza di dissolversi o meno in un dato liquido. In quanto proprietà specifica del materiale, è utile per identificare una sostanza.
d) CORRETTO. La temperatura di ebollizione corrisponde alla temperatura di passaggio dallo stato liquido a quello gassoso. In quanto proprietà specifica del materiale, è utile per identificare una sostanza.
e) CORRETTO. La temperatura di fusione corrisponde alla temperatura di passaggio dallo stato liquido a quello solido. In quanto proprietà specifica del materiale, è utile per identificare una sostanza.
2. (Vunesp) L'etichetta di una bottiglia di acqua minerale è riprodotta di seguito.
| Probabile composizione chimica: |
|---|
| Solfato di calcio 0,0038 mg/L |
| Bicarbonato di calcio 0,0167 mg/L |
Sulla base di queste informazioni, possiamo classificare l'acqua minerale come:
a) sostanza pura.
b) sostanza semplice.
c) miscela eterogenea.
d) miscela omogenea.
e) sospensione colloidale.
Alternativa corretta: d) miscela omogenea.
a) SBAGLIATO. L'acqua sarebbe pura se la sua composizione avesse solo molecole di H2O.
b) SBAGLIATO. Una sostanza semplice è costituita da atomi di un solo elemento chimico. Né l'acqua pura è una sostanza semplice, poiché è formata da atomi di idrogeno e ossigeno (H2O) è classificato come composito.
c) SBAGLIATO. Una miscela eterogenea ha più di una fase, nel qual caso possiamo osservare solo l'acqua.
d) CORRETTO. Poiché ha una sola fase, il sistema è omogeneo. Guardando la bottiglia d'acqua, possiamo vedere solo il liquido, poiché i composti di solfato di calcio e bicarbonato di calcio sono solubili in acqua e quindi si sciolgono.
e) SBAGLIATO. Una sospensione colloidale è una miscela eterogenea i cui componenti vengono differenziati al microscopio.
3. (UCDB) In un laboratorio di chimica sono state preparate le seguenti miscele:
IO. acqua/benzina
II. acqua/sale
III. acqua/sabbia
IV. benzina/sale
v. benzina/sabbia
Quali di queste miscele sono omogenee?
a) Nessuno.
b) Solo II.
c) II e III.
d) I e II.
e) II e IV.
Alternativa corretta: b) Solo II.
a) SBAGLIATO. L'acqua è un composto inorganico e la benzina un composto organico. Queste sostanze non hanno la capacità di interagire e poiché hanno densità diverse formano una miscela eterogenea.
b) CORRETTO. Il sale, cloruro di sodio, si scioglie in acqua formando una soluzione, che è una miscela omogenea.
c) SBAGLIATO. La sabbia, il biossido di silicio, forma una miscela eterogenea con l'acqua.
d) SBAGLIATO. Il sale è un composto inorganico e la benzina un composto organico. Queste sostanze non hanno la capacità di interagire e poiché hanno densità diverse formano una miscela eterogenea.
e) SBAGLIATO. La sabbia è un composto inorganico e la benzina un composto organico. Queste sostanze non hanno la capacità di interagire e quindi formano una miscela eterogenea.
4. (Ufes) In un sistema ben misto composto da sabbia, sale, zucchero, acqua e benzina, il numero di fasi è:
a) 2.
b) 3.
c) 4.
d) 5.
e) 6.
Alternativa corretta: b) 3.
FASE 1: Sale e zucchero sono in grado di interagire con l'acqua e attraverso forze intermolecolari le molecole si legano e formano una soluzione, che è una miscela omogenea.
FASE 2: L'acqua è un composto inorganico e la benzina un composto organico. Queste sostanze non hanno la capacità di interagire e poiché hanno densità diverse formano una miscela eterogenea.
FASE 3: La sabbia è un silicato che non ha affinità chimica con l'acqua e la benzina e, quindi, rappresenta una fase.
5. (Mackenzie) La miscela formata da:
a) cubetti di ghiaccio e soluzione acquosa di zucchero (glucosio).
b) N gas2 e CO2.
c) acqua e acetone.
d) acqua e sciroppo di uva spina.
e) cherosene e gasolio.
Alternativa corretta: a) cubetti di ghiaccio e soluzione acquosa di zucchero (glucosio).
a) CORRETTO. È possibile osservare due fasi: i cubetti di ghiaccio e la soluzione di glucosio, quindi sono un sistema eterogeneo.
b) SBAGLIATO. I gas sono sempre una miscela omogenea.
c) SBAGLIATO. Si formano legami idrogeno tra il carbonile del propanone e la molecola d'acqua. Essendo sostanze polari, l'acetone è in grado di solubilizzarsi in acqua e formare una miscela omogenea.
d) SBAGLIATO. Questi due componenti si mescolano per formare un sistema omogeneo, poiché vedremo solo un liquido rosso dallo sciroppo di uva spina, poiché si verifica una diluizione aggiungendo acqua.
e) SBAGLIATO. Entrambi sono composti organici e per affinità chimica formano un'unica fase, rappresentando un sistema omogeneo.
Metti alla prova le tue conoscenze con gli esercizi:
- Esercizi su miscele omogenee ed eterogenee
- Esercizi sulla separazione delle miscele
- Esercizi sulle proprietà della materia


