Il Valence Layer è l'ultimo strato della distribuzione elettronica di un atomo. Essendo lo strato più esterno, è anche il più lontano dal nucleo atomico.
Secondo il Regola dell'ottetto, il guscio di valenza ha bisogno di otto elettroni per stabilizzarsi.
Pertanto, gli atomi acquisiscono stabilità quando hanno 8 elettroni nel guscio di valenza. Questo accade con i gas nobili, hanno lo strato di valenza completo. L'unica eccezione è l'elemento Elio che ha 2 elettroni.
Gli altri elementi devono creare legami chimici per ricevere gli elettroni mancanti e raggiungere gli otto elettroni nel guscio di valenza.
Gli elettroni del guscio di valenza sono quelli che partecipano ai legami, in quanto sono i più esterni.
Strati di elettrosfera
Secondo il modello atomico di Rutherford-Bohr, gli elettroni ruotano attorno al nucleo atomico, in diversi strati energetici.
Ci sono sette strati designati dalle lettere K, L, M, N, O, P e Q. Ciascuno supporta un numero massimo di elettroni.
 Strati elettronici e numero di elettroni che supportano
Strati elettronici e numero di elettroni che supportano
Leggi anche:
- Il modello atomico di Bohr
- Modello atomico di Rutherford
- Gas nobili
- Regola dell'ottetto
Come determinare lo strato di Valencia?
Lo strato di valenza può essere determinato in due modi: Distribuzione elettronica e Tavola periodica.
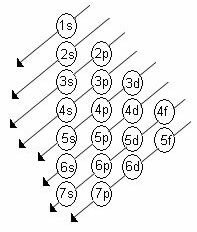
Per determinare lo strato di valenza attraverso la distribuzione elettronica, il Diagramma di Linus Pauling.
 diagramma di Paulinging
diagramma di Paulinging
Ricordiamo che il diagramma di Pauling segue l'ordine crescente dell'energia. L'ultimo strato ottenuto nella distribuzione elettronica è lo strato di valenza.
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5 D10 6p6 7s2 5f14 6d10 7p6
Quindi, nello strato di valenza, il sottolivello più energetico è l'ultimo strato.
Esempi:
Azoto - N
Numero atomico: 7
Distribuzione elettronica: 1s2 2s2 2p3
Livello Valencia: 2s2 2p3, N ha 5 elettroni nel guscio di valenza.
Ferro - Fe
Numero atomico: 26
Distribuzione elettronica: 1s2 2s2 2p6 3s2 3p6 4s2 3d6
Livello Valencia: 4s2, Fe ha 2 elettroni nel guscio di valenza.
Cloro - Cl
Numero atomico: 17
Distribuzione elettronica: 1s2 2s2 2p6 3s2 3p5
Livello Valencia: 3s2 3p5, Cl ha 7 elettroni nel guscio di valenza.
Ossigeno - O
Numero atomico: 8
Distribuzione elettronica: 1s2 2s2 2p4
Livello Valencia: 2s2 2p4, l'ossigeno ha 6 elettroni nel guscio di valenza.
Carbonio - C
Numero atomico: 6
Distribuzione elettronica: 1s2 2s2 2p2
Livello Valencia: 2s2 2p2, il carbonio ha 4 elettroni nel guscio di valenza.
Leggi anche su Numeri Quantici.
Finora gli esempi utilizzati erano con elementi allo stato fondamentale. Ma lo stesso principio può essere usato per ioni, cationi e anioni. Vedi l'esempio:
Anione cloruro - Cl-
Il numero atomico del cloro è 17. Se fosse nel suo stato fondamentale, il numero di elettroni sarebbe uguale al numero di protoni. Tuttavia, in questo caso si ha un guadagno di 1 elettrone.
Per prima cosa, realizza la distribuzione elettronica per l'elemento Cloro:
1s2 2s2 2p6 3s2 3p5
Con il guadagno di un elettrone in più, aggiungi nell'ultimo strato:
1s2 2s2 2p6 3s2 3p6. Quindi ci sono 8 elettroni nel guscio di valenza (3s2 3p6).
Vedi anche: Esercizi sulla distribuzione elettronica.
Per determinare lo strato di valenza attraverso la tavola periodica, è necessario identificare il periodo e la famiglia degli elementi.
Quindi, mentre la famiglia 1A ha 1 elettrone di valenza, 2A ne ha 2 e così via. Gli elementi chimici in esso contenuti famiglia della tavola periodica hanno lo stesso numero di elettroni nel guscio di valenza.
Tuttavia, questo è valido solo per i gruppi 1, 2, 13, 14, 15, 16 e 17 che hanno i seguenti numeri di elettroni nel guscio di valenza 1, 2, 3, 4, 5, 6 e 7, rispettivamente.
Per gli elementi in cui questa relazione non è possibile, dovrebbe essere utilizzata la distribuzione elettronica.
Non dimenticare! A legami chimici nascono dalla necessità di stabilizzare gli atomi e quindi formare molecole. Questo viene fatto donando elettroni dal guscio di valenza, che, essendo più lontani dal nucleo, hanno la tendenza a donare.
Leggi anche su Geometria Molecolare.
Esercizi
1. Trova lo strato di valenza dei seguenti elementi:
Bromo
35fratello
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5
Il guscio di valenza del bromo (famiglia 7A) ha 7 elettroni. Questo perché 4s2 e 4p5 appartengono allo strato N, mentre 3d10 appartiene allo strato M.
Alluminio
13Al
1s2 2s2 2p6 3s2 3p1
Il guscio di valenza in alluminio (famiglia 3A) ha 3 elettroni.
2. (UFSC) Il numero di elettroni in ciascun sottolivello dell'atomo di stronzio (38Sr) in ordine crescente di energia è:
a) 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2
b) 1s2 2s2 2p6 3s2 3p6 4s2 4p6 3d10 5s2
c) 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 5s2
d) 1s2 2s2 2p6 3s2 3p6 4p6 4s2 3d10 5s2
e) 1s2 2s2 2p6 3p6 3s2 4s2 4p6 3d10 5s2
a) 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2
3. (IFSP/2013) Il numero di elettroni nel guscio di valenza dell'atomo di calcio (Z = 20), allo stato fondamentale, è
a 1
b) 2
c) 6
d) 8
e) 10
b) 2
Controlla le domande dell'esame di ammissione con una risoluzione commentata in: Esercizi sulla tavola periodica.