Il punto di fusione e il punto di ebollizione rappresentano la temperatura alla quale una sostanza cambia stato ad una data pressione.
Nel caso del punto di fusione, la sostanza passa dallo stato solido allo stato liquido. Il punto di ebollizione si riferisce al passaggio da uno stato liquido a uno stato gassoso.
Ad esempio, il ghiaccio inizia a trasformarsi in acqua in forma liquida quando la sua temperatura è pari a 0°C. Quindi, il punto di fusione dell'acqua è 0 ° C (sotto una pressione di 1 atmosfera).
Per passare da liquido a vapore, l'acqua deve raggiungere una temperatura di 100°C. Pertanto, il punto di ebollizione dell'acqua è di 100 ° C (sotto una pressione di 1 atmosfera).

Punto di fusione
Quando una sostanza allo stato solido riceve calore, c'è un aumento del grado di agitazione delle sue molecole. Di conseguenza anche la sua temperatura aumenta.
Al raggiungimento di una certa temperatura (punto di fusione), l'agitazione delle molecole è tale da rompere i legami interni tra atomi e molecole.
A questo punto la sostanza inizia a cambiare stato e se continua a ricevere calore passerà allo stato liquido.
Durante Fusione la sua temperatura rimane costante, in quanto il calore ricevuto viene utilizzato esclusivamente per il cambio di stato.

Il calore per unità di massa richiesto per cambiare fase è chiamato Calore latente di fusione (Lf) ed è una caratteristica della sostanza.
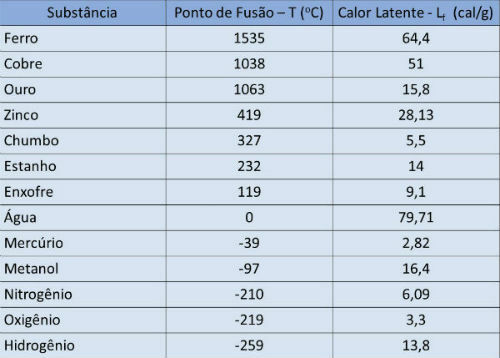
Punto di fusione e tabella del calore latente
Nella tabella sottostante indichiamo la temperatura di fusione e il calore latente di alcune sostanze per pressione atmosferica.
Punto di ebollizione
IL bollente è caratterizzato dal rapido passaggio da uno stato liquido a uno gassoso, con formazione di vapori (bolle) all'interno del liquido.
Come nella fusione, esiste una temperatura (punto di ebollizione) alla quale una data sostanza passa da uno stato liquido a uno gassoso.
Perché ciò avvenga, la sostanza deve ricevere calore. Durante l'intero cambiamento di fase, la temperatura rimane costante.
il calore latente di vaporizzazione (Lv) è la quantità di calore per unità di massa necessaria affinché una sostanza cambi fase.
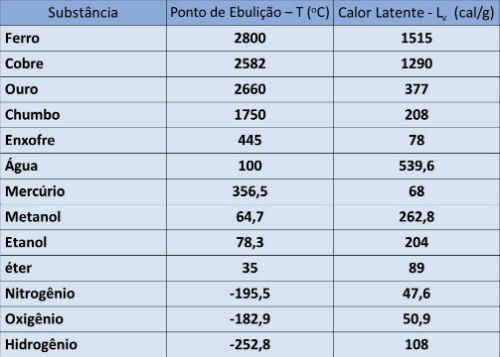
Punto di ebollizione e tabella calore latente
Nella tabella sottostante indichiamo la temperatura di ebollizione e il calore latente di vaporizzazione di alcune sostanze a pressione atmosferica.
Interferenza di pressione
La temperatura del punto di fusione e del punto di ebollizione dipende dalla pressione esercitata sulla sostanza.
In generale, le sostanze aumentano di volume quando vanno incontro a fusione. Questo fatto significa che maggiore è la pressione, maggiore è la temperatura alla quale la sostanza cambia fase.
L'eccezione si verifica con alcune sostanze, compresa l'acqua, che diminuisce di volume quando viene sciolta. In questo caso, una pressione maggiore abbasserà il punto di fusione.

Una diminuzione della pressione fa abbassare il punto di ebollizione di una data sostanza, il che significa che la sostanza bolle a una temperatura più bassa.
Ad esempio, in luoghi sopra il livello del mare l'acqua bolle a temperature inferiori a 100°C. Di conseguenza, la cottura in questi luoghi richiede molto più tempo che in luoghi a livello del mare.
Leggi anche:
- Cambiamenti di stato fisico
- Bilance Termometriche
- Bilance Termometriche - Esercizi
- Stati fisici dell'acqua
- Diagramma delle fasi
- solidificazione
- Condensazione
- Proprietà colligative
- Proprietà periodiche
- Evaporazione
- Esercizi sulla tavola periodica


