Analisi volumetrica o volumetria è un procedura di laboratorio in cui utilizziamo un certo volume di a soluzione nel concentrazione noto per determinare la concentrazione di un'altra soluzione. Il volume della soluzione a concentrazione nota sarà determinato quando reagisce completamente con la soluzione a concentrazione sconosciuta, cioè le soluzioni coinvolte devono reagire tra loro.
Gli strumenti più utilizzati per misurare un dato volume sono:
- Pipetta

Esempio di pipetta utilizzata nella misurazione del volume
- Buretta

La buretta è un importante strumento di misura volumetrica
La misurazione del volume si effettua valutando l'altezza del cosiddetto menisco, che altro non è che la regione superficiale del liquido, che presenta un aspetto rettangolare o bombato (forma a goccia), a seconda dello spessore del contenitore. Più ampio è il contenitore, più rettangolare è il menisco; più sottile è il contenitore, più convesso sarà. Per valutare il menisco, l'occhio deve essere esattamente alla sua altezza e dobbiamo prendere come riferimento la regione inferiore, se il menisco è rettangolare, o la punta, se rigonfia. Vedere una rappresentazione di una valutazione:
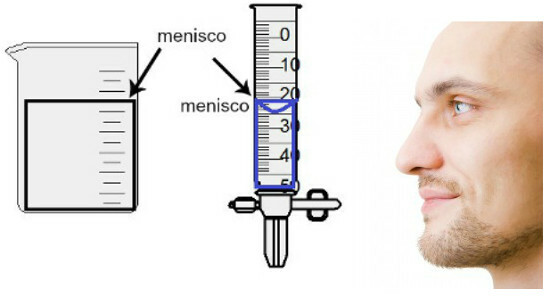
Per valutare un menisco, è importante che i tuoi occhi guardino verso di esso.
Nell'analisi volumetrica, l'attrezzatura più utilizzata è la buretta. Questo perché, poiché il metodo prevede reazioni chimiche e queste possono essere lavorate rapidamente, la buretta consente il liquido viene rilasciato alla sua punta in gocce, il che ci consente di impedire al liquido di fuoriuscire di più controllato.
Una delle procedure più utilizzate all'interno della volumetria è il titolazione. È un'analisi volumetrica che prevede il verificarsi di una reazione tra un acido e una base o viceversa. L'attrezzatura necessaria per la sua realizzazione è rappresentata nell'immagine sottostante:
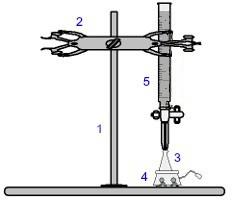
Rappresentazione dell'attrezzatura utilizzata in una titolazione
I numeri in blu significano:
1) Supporto universale;
2) Artiglio (usato per tenere la buretta);
3) Erlenmeyer (riceve la soluzione di concentrazione sconosciuta);
4) Agitatore magnetico (usato per agitare la soluzione presente nella beuta di Erlenmeyer);
5) Buretta (riceve la soluzione a concentrazione nota).
Un volume della soluzione di concentrazione sconosciuta con l'indicatore della fenolftaleina viene aggiunto alla beuta (immediatamente la soluzione diventerà rosa). Nella buretta viene posto un certo volume della soluzione a concentrazione nota. Quindi, la soluzione acida della buretta viene gocciolata direttamente nella soluzione basica nella beuta di Erlenmeyer. Questo gocciolamento dura fino a quando la soluzione di base diventa incolore, a quel punto chiamiamo punto di svolta, che indica che tutta la base presente nella soluzione ha completamente reagito con l'acido.
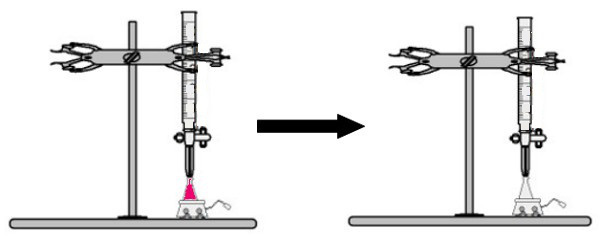
Alla svolta, la soluzione non è più rosa e diventa incolore
Osservazione: Se la soluzione di concentrazione sconosciuta è acida, quando riceve l'indicatore della fenolftaleina, sarà incolore. Quindi, il punto di svolta nella titolazione sarà quando la soluzione acida diventa rosa quando riceve la soluzione basica dalla buretta.
Infine, per determinare la concentrazione della soluzione di base, basta usare la seguente equazione:
Ma.Va = Mb.Vb
Ma = molarità acida;
Va = volume acido;
Mb = molarità di base;
Vb = volume di base.
Ora segui un esempio di come viene eseguito il calcolo di una soluzione con molarità sconosciuta.
1) 30 mL di una soluzione di base sconosciuta sono stati aggiunti ad una beuta di Erlenmeyer per eseguire una titolazione per determinarne la concentrazione (molarità). Nella buretta sono stati aggiunti 50 ml di una soluzione acida con una concentrazione di 0,2 mol/L. Dopo aver gocciolato la soluzione acida e fino alla titolazione della soluzione basica, si è osservato che nella titolazione sono stati utilizzati 20 mL della soluzione acida. Determinare la molarità della soluzione di base utilizzata.
Dati di esercizio:
Vb = 30 ml
Mb = ?
Ma = 0,2 mol/L
Va = 20 ml
Poiché la molarità dell'acido e il suo volume sono, rispettivamente, 0,2 mol/L e 20 mL, e il volume della base utilizzata è 30 mL, basta usare la formula di titolazione:
Ma.Va = Mb.Vb
0.2.20 = Mb.30
4 = Mb.30
4 = Mb
30
Mb = 0,133 mol/L
Di Me. Diogo Lopes Dias
Fonte: Scuola Brasile - https://brasilescola.uol.com.br/quimica/analise-volumetrica.htm

