Gli elementi che prendono il nome metalli alcalino-terrosi sono quelli che appartengono alla famiglia 2 o IIA, della Tavola Periodica. Tale gruppo comprende i seguenti elementi chimici: Be (Berillio), Mg (Magnesio), Ca (Calcio), Sr (Stronzio), Ba (Bario) e Radio (Ra).

Hanno due elettroni nel guscio di valenza e la loro distribuzione generica è rappresentata da ns2, dove no rappresenta il numero dell'ultimo livello. Per questa loro caratteristica tendono a perdere questi due elettroni, dando origine a cationi di carica 2+.
Il termine "terra" si riferisce a "esistente sulla terra", poiché è qui che si trovano questi elementi, principalmente nei minerali. Ad esempio, il calcio, sotto forma del composto di fosfato di calcio (Ca3(POLVERE4)2), si trova nella crosta terrestre e serve come materia prima per la produzione di fosforo. È presente anche nelle ossa degli animali, tanto che quando queste vengono calcinate si ottiene la cosiddetta “farina di ossa”, che contiene fosfato di calcio.
Tra i metalli alcalino terrosi quelli che spiccano di più sono i Calcio è il Magnesio.
- Calcio
Lo ione calcio (Ca2+) è presente in circa il 90% delle nostre ossa e denti; e negli animali è presente anche nei loro gusci. La sua funzione è quella di rafforzare la struttura ossea e fungere da rilassante muscolare. La mancanza di calcio nel corpo può causare crampi muscolari, tetano e osteoporosi. Ecco perché è importante consumarlo attraverso cibi ricchi di calcio, come latte e suoi derivati (burro, formaggio, ecc.), carne e verdure.
D'altra parte, troppo calcio può causare rilassamento muscolare, calcoli renali e dolore osseo.
Oltre ai suddetti alimenti, il calcio è ancora presente in molte parti della natura, soprattutto in minerali come la calcite (CaCO3) o carbonato di calcio, che è un costituente del calcare e del marmo, e il marmo è utilizzato nella fabbricazione di lavandini, statue, pavimenti e scale. Il carbonato di calcio è anche il costruttore di stalattiti e stalagmiti nelle grotte. Il calcio è presente anche nel gesso naturale (CaSO4. 2 ore2O), detto gesso. Questo sale può essere disidratato, dando origine a CaSO4 anidro, che è gesso scolastico.
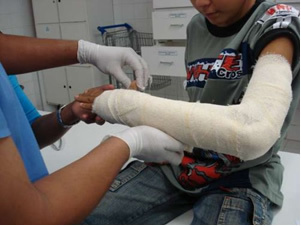
Nell'industria si produce calce vergine (CaO), calce spenta, detta anche calce idrata o calce spenta, che in realtà è idrossido di calcio (Ca (OH)2), utilizzato nelle pitture da imbiancatura e nella preparazione della malta. Il dolce riscaldamento del gesso permette di ottenere il solfato di calcio emiidrato, che è il gesso, utilizzato in edilizia società civile, nella produzione di stampi in Odontoiatria e Medicina per proteggere le fratture ossee, come quella del braccio sotto illustrata.
- Magnesio
lo ione di magnesio ha anche una grande importanza biologica, in quanto è presente nel 70% delle nostre ossa, favorendo l'azione degli enzimi, dei muscoli e della coordinazione motoria. La sua mancanza nel corpo può causare disorientamento, ipertensione, tremori e polso debole. Pertanto, dovremmo mangiare i seguenti alimenti che contengono questo elemento: noci, cereali e verdure verdi. Inoltre, l'eccesso di magnesio nel corpo può causare sonnolenza.
Il magnesio esiste anche nell'acqua di mare e nei minerali. Viene utilizzato nelle leghe metalliche, come i metalli sacrificali (che si ossidano al posto dell'acciaio, prevenendo la sua corrosione), nelle ruote in “magnesio” e nei fuochi d'artificio (offrono i colori argento e bianco). Un composto molto importante del magnesio è l'idrossido di magnesio (Mg(OH)2), che, disperso in acqua, ad una concentrazione di circa il 7%, dà luogo ad una sospensione nota popolarmente come latte di magnesia, che funge da antiacido, combatte l'acidità di stomaco (bruciore di stomaco) e come lassativo.

di Jennifer Fogaça
Laureato in Chimica
Fonte: Scuola Brasile - https://brasilescola.uol.com.br/quimica/metais-alcalinoterrosos.htm
