L'allotropia è un fenomeno che si verifica quando lo stesso elemento chimico ha la proprietà di formare più di una sostanza semplice.. Queste varietà allotropiche possono differire a causa del numero di atomi dell'elemento che sono legati insieme in una molecola o per la disposizione degli atomi nel reticolo cristallino.
Uno degli elementi che hanno varietà allotropiche è il fosforo (P), il più comune è il fosforo bianco è il fosforo rosso. Questi due allotropi del fosforo differiscono non per la loro diversa disposizione spaziale, poiché entrambi sono fondamentalmente costituiti da molecole tetraedriche, ma la quantità di atomi di fosforo è diversa in ciascuno.
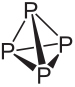
Vedi la costituzione e le principali caratteristiche del fosforo bianco e rosso:
- Fosforo Bianco:
La formula molecolare del fosforo bianco è P4, il che significa che le sue molecole sono costituite da quattro atomi di fosforo.

Questo tipo di fosforo è estremamente reattivo, in gran parte a causa della tensione agli angoli di 60° tra i suoi legami. È così reattivo che deve essere conservato in acqua in modo che non entri in contatto con l'aria ed esploda. Bisogna fare molta attenzione quando lo si maneggia, poiché provoca gravi ustioni cutanee e avvelenamento se ingerito (solo 0,1 g di fosforo bianco ingerito possono portare alla morte).
Come puoi vedere di seguito, il fosforo bianco è un solido bianco simile alla cera.

Fosforo bianco immagazzinato in acqua per non entrare in contatto con l'aria*
Se riscaldato in assenza di aria, il fosforo bianco si trasforma in fosforo rosso.
- fosforo rosso:
Il fosforo rosso non ha una struttura determinata, ma vi sono prove che si tratti di macromolecole formate dal legame delle strutture tetraedriche citate (P4), rappresentato da Pno.
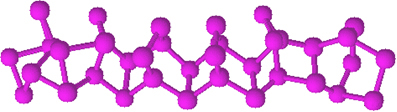
È molto meno reattivo del fosforo bianco, tuttavia può prendere fuoco se strofinato. Ecco perché viene utilizzato sulle superfici laterali delle scatole di fiammiferi. Quando strofiniamo lo stuzzicadenti sulla superficie della scatola, il fiammifero si accende e, a sua volta, accende il materiale altamente infiammabile sulla testa dello stuzzicadenti.
In alcuni paesi il fiammifero viene posizionato sulla testa dello stuzzicadenti sotto forma di P4S3.
Il fosforo rosso è una polvere amorfa, cioè non ha una struttura cristallina, ed è di colore rosso scuro, come mostrato di seguito:

Polvere di fosforo rosso.
* La paternità dell'immagine appartiene a W. Oelen e lei possono essere trovati qui.
di Jennifer Fogaça
Laureato in Chimica
Fonte: Scuola Brasile - https://brasilescola.uol.com.br/quimica/alotropia-fosforo.htm
