Idrocarburi, detti anche carburi di idrogeno, sono composti organici la cui composizione ha solo atomi di carbonio (C) e da idrogeno (H), avendo così la formula generale CXHsì.
Un idrocarburo è costituito da una struttura di carbonio alla quale gli atomi di idrogeno si legano in legame covalente.
È il composto più importante nella chimica organica.
Tutti i tipi di idrocarburi si ossidano facilmente, rilasciando così calore. La maggior parte di essi non è solubile in acqua.
Gli idrocarburi naturali sono composti chimici formati all'interno della Terra (a più di 150 km da profondità) ad alta pressione e raggiungere zone di minore pressione attraverso processi geologici.
Dove si trovano gli idrocarburi?
La principale fonte di idrocarburi è il petrolio. Per questo motivo, l'idrocarburo è presente in diversi derivati come such cherosene, paraffina, gas naturale, Benzina, Vaselina, diesel, GPL (Gas di petrolio liquefatto), polimeri (come plastica e gomma), tra gli altri.
Questo composto organico costituisce il 48% della matrice energetica del Brasile.
La catena di carbonio che costituisce parte della composizione di un idrocarburo è tetravalente, ovvero può effettuare quattro connessioni.
Il carbonio è in grado di legarsi con altri atomi di carbonio e con gli idrogeni attraverso link semplici, raddoppia o triplica.
Classificazione degli idrocarburi
La classificazione degli idrocarburi si basa su tre specificità: a modulo della catena principale del carbonio, il Connessioni delle catene di carbonio, il presenza di radicali alchilici nella catena del carbonio e presenza di eteroatomi dividere la catena del carbonio.
saperne di più su idrogeno.
Forma principale della catena in carbonio
Per quanto riguarda la forma della catena carboniosa principale, la classificazione degli idrocarburi è suddivisa in alifatico e ciclico.
Scopri in cosa consiste ciascuna di queste forme di catena del carbonio.
idrocarburi alifatici
Gli idrocarburi alifatici sono formati da catene di carbonio Aperto o aciclico. In queste catene, i carboni sono terminali.
Esempi:
alcano
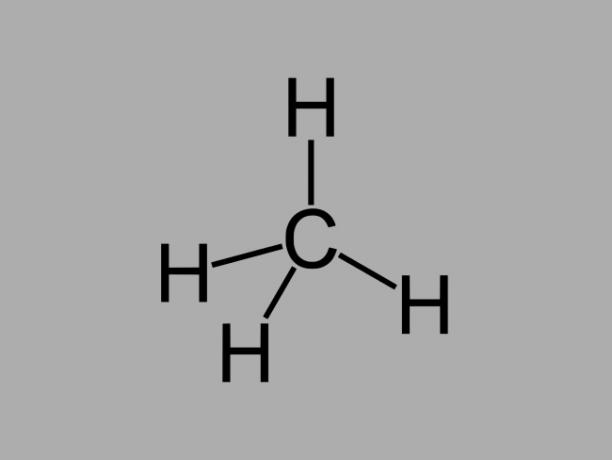
Idrocarburi alcani, detti anche paraffine o paraffinico, sono composti oleosi in cui esistono solo singoli legami tra i carboni.
La formula generale per un alcano è CnoH2no + 2 (n = qualsiasi numero intero).
alchene
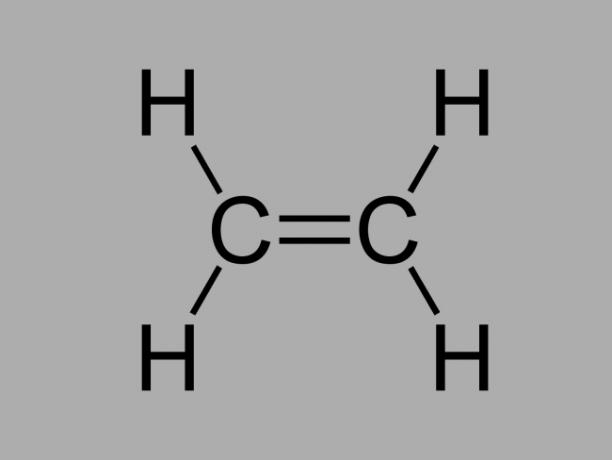
Chiamato anche olefina, alchene o idrocarburo di etilene, l'alchene è un composto scarsamente reattivo dove c'è un doppio legame tra i carboni.
La formula generale per un alchene è CnoH2no.
alchino
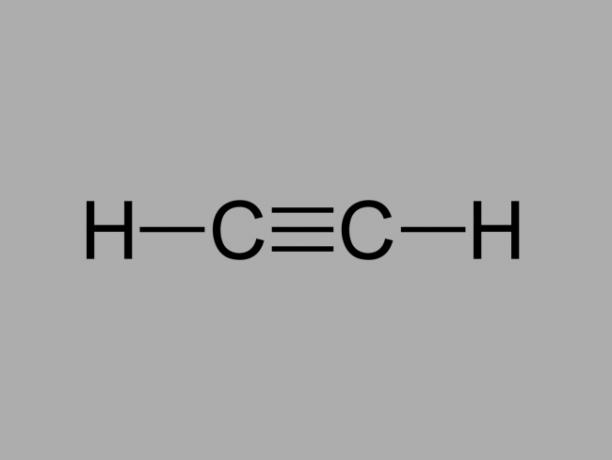
Chiamato anche metilacetilene, l'alchino è un idrocarburo in cui i legami esistenti tra i carboni sono tripli.
La formula generale per un alchino è CnoH2no-2.
alcadiene

Chiamati anche dieni o diolefine, gli alcadieni sono idrocarburi in cui i legami tra i carboni sono doppi.
La formula generale per un alcadiene è CnoH2no-2.
Idrocarburi ciclici
Gli idrocarburi ciclici sono formati da catene di carbonio chiuse o cicliche. Queste catene non hanno carboni terminali.
Esempi:
Cyclan
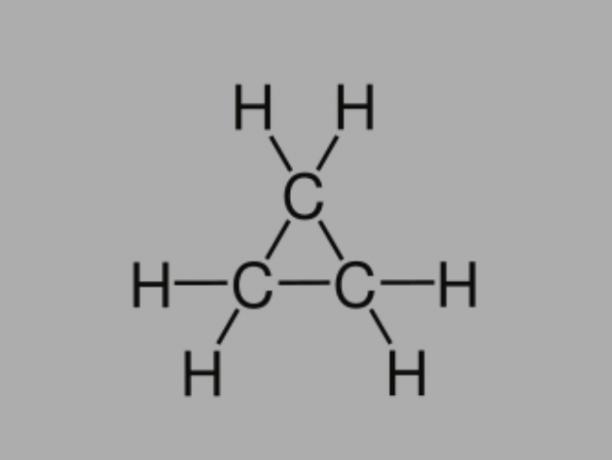
Chiamato anche cicloalcano, cicloparaffina o idrocarburo naftenico, il ciclano è un idrocarburo saturo, composto da singoli legami.
Ha una catena di carbonio chiusa e la sua formula generale è CnoH2no.
ciclonico

Chiamato anche cicloalcheni, i cicli sono idrocarburi insaturi, composti da doppi legami.
Un ciclone ha una catena di carbonio chiusa e la sua formula generale è CnoH2no−2.
ciclista
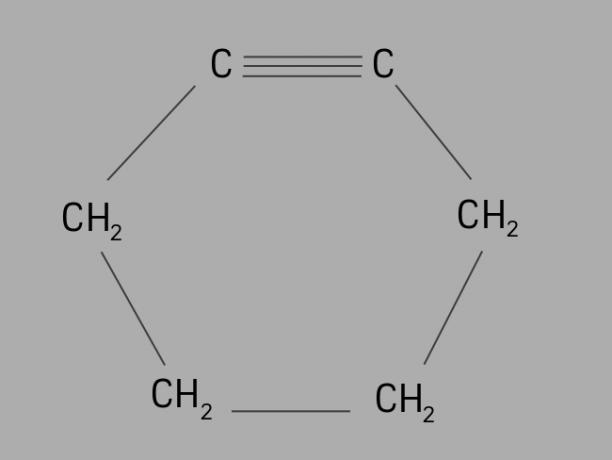
Chiamato anche cicloalchino o cicloalchino, la ciclina è un idrocarburo ciclico e insaturo.
È formato da una catena di carbonio chiusa, con tripli legami e la sua formula generale è CnoH2no-4.
Aromatico

o

Chiamato anche arene, gli idrocarburi aromatici sono composti insaturi formati da doppi legami.
Un aromatico ha una catena di carbonio chiusa o ciclica e la sua formula generale è C6H6.
Tipo di legame delle catene di carbonio
A seconda del tipo di legame delle catene di carbonio, gli idrocarburi possono essere classificati in saturato o insaturo.
Vedi sotto in cosa consiste ciascuna di queste classificazioni.
Idrocarburi saturi
Gli idrocarburi saturi sono formati da link semplici.
Esempi: alcani, ciclani.
idrocarburi insaturi
Gli idrocarburi insaturi sono formati da doppi legami o triplica.
Esempi: alcheni, alchini, alcadieni.
Presenza di radicali alchilici
Per quanto riguarda la presenza di radicali alchilici, gli idrocarburi possono avere una catena di carbonio normale o ramificato.
catena di carbonio normale
Un normale idrocarburo a catena di carbonio non ha radicali alchilici.
Esempio: pentano
catena di carbonio ramificata
Quando un idrocarburo ha una catena di carbonio ramificata, significa che la sua catena di carbonio principale ha radicali alchilici.
Esempio: metilpropano
Presenza di eteroatomi che dividono la catena del carbonio
La catena sequenziale di carbonio può o non può essere divisa a seconda della presenza di eteroatomi.
Catena di carbonio omogenea
Quando un idrocarburo ha una catena carboniosa principale omogenea, significa che questa catena non è diviso da eteroatomi.
Catena di carbonio eterogenea
Se un idrocarburo ha una catena di carbonio principale eterogenea, questa catena ha il suo catena di carbonio divisa da un eteroatomo.
Nomenclatura degli idrocarburi
La nomenclatura degli idrocarburi è definita attraverso una combinazione di tre parti:

Il prefisso identifica la quantità di atomi di carbonio, l'intermedio identifica il tipo di legame e il suffisso indica la funzione a cui appartiene il composto (in questo caso la classe degli idrocarburi).
Vedi sotto per l'elenco dei prefissi e degli intermedi che sono combinati per designare gli idrocarburi.
Elenco dei prefissi
| Numero di atomi di carbonio | Prefisso |
|---|---|
| 1 | Incontrato- |
| 2 | Et- |
| 3 | Puntello- |
| 4 | Ma- |
| 5 | pentito- |
| 6 | Esadecimale- |
| 7 | Hept- |
| 8 | ottobre- |
| 9 | Non- |
| 10 | dic- |
Elenco intermediari
| Tipo di connessione | procacciatore d'affari |
|---|---|
| Solo chiamate singole | -un- |
| Paio | -it- |
| triplicare | -nel- |
| due coppie | -dien- |
Guarda alcuni esempi di denominazione degli idrocarburi.
Esempi:
CH3 – CH2 – CH2 – CH3
Nella forma strutturale sopra, possiamo vedere un composto a 4 atomi di carbonio che ha solo legami singoli (indicati dal simbolo “–”).
- Prefisso per 4 carboni = ma-
- Intermedio per le associazioni singole= -an-
- Suffisso di un idrocarburo= -o
Vedi che l'unione di prefisso + intermedio + suffisso dà origine al nome BUTANO.
CH2 = CH2
La forma strutturale sopra ha 2 atomi di carbonio e 1 doppio legame (indicato dal simbolo “=”).
- Prefisso per 2 carboni = et-
- Intermedio per doppi legami= -en-
- Suffisso di un idrocarburo= -o
Vedi che l'unione di prefisso + intermedio + suffisso dà origine al nome ETENE.
CH2 = CH - CH2 – CH3
CH3 – CH = CH2 – CH3
Si noti che entrambe le forme strutturali di cui sopra hanno 4 atomi di carbonio e 1 doppio legame (indicato dal simbolo "=").
Quindi, abbiamo:
- Prefisso per 4 carboni = ma-
- Intermedio per doppi legami= -en-
- Suffisso di un idrocarburo= -o
Vedi che l'unione di prefisso + intermedio + suffisso darebbe origine al nome BUTENE per le due forme strutturali.
Tuttavia, si noti che le forme strutturali non sono identiche, quindi nemmeno le nomenclature.
La differenza tra le due forme strutturali risiede nella posizione del doppio legame.
In questo caso, dobbiamo numerare i carboni della catena dall'estremità più vicina al doppio. Pertanto, nei casi in questione, dobbiamo numerare da sinistra a destra.
Nel CH2 = CH - CH2 – CH3:
- CH2 sarà l'1
- CH sarà il 2
- CH2 sarà il 3
- CH3 sarà il 4
Nota che il doppio legame è tra i carbonio 1 è il carbonio 2.
Dobbiamo usare il numero più piccolo (1) per trovare il doppio legame: BUTENE -1
Nel CH3 – CH = CH2 – CH3:
- CH3 sarà l'1
- CH sarà il 2
- CH2 sarà il 3
- CH3 sarà il 4
Si noti che il doppio legame è tra carbonio 2 è il carbonio 3.
Dobbiamo usare il numero più piccolo (2) per trovare il doppio legame: BUTENE -2
Secondo IUPAC (Unione Internazionale di chimica pura e applicata – International Union of Pure and Applied Chemistry), la posizione deve essere indicata poco prima del essendo localizzato (nel caso delle formali strutturali di cui sopra, il doppio legame, rappresentato dall'intermedio “-it-”).
Con ciò, abbiamo un secondo modo, che tra l'altro è il più corretto, di scrivere la nomenclatura delle forme strutturali disponibili.
CH2 = CH - CH2 – CH3: BUTENE -1 o BUT-1-ENO (forma più corretta)
CH3 – CH = CH2 – CH3: BUTENE -2 o BUT-2-ENE (forma più corretta)
Impara di più riguardo IUPAC e nomenclatura.
