La densità è una grandezza fisica che misura la concentrazione di materia di un corpo in un dato volume.
Si ottiene dal rapporto tra massa corporea e volume e si misura in kg/m3 nel Sistema Internazionale di Unità (SI).
La densità di un corpo è inversamente proporzionale al suo volume, cioè maggiore è il volume, minore è la densità. Nota questa relazione nella formula della densità:

La densità è la proprietà che determina se un corpo galleggerà o affonderà in un liquido. Se il materiale è meno denso del liquido, galleggerà, ma se ha una densità maggiore del liquido, affonderà.
Tutti i materiali presenti in natura hanno una densità misurabile. La densità dipende dal tipo di materiale, di stato fisico dove si trova e le condizioni di temperatura e pressione ambientale.
Come calcolare la densità?
Per calcolare la densità di una sostanza o di una miscela di sostanze, dividere la massa corporea per il suo volume, secondo la formula:
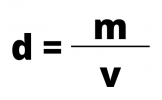
Dove:
- d = densità misurata in kg/m3, g/cm3 o g/ml
- m = massa misurata in kg o g
- v = volume misurato in m3, cm3 o ml
È importante tenere presente che poiché il volume di un corpo cambia in diverse condizioni di temperatura e pressione, la densità sarà diversa al variare della temperatura e della pressione.
Ad esempio, l'acqua ha una densità di circa 1 g/cm3 in condizioni ambientali, ma quando diventa ghiaccio la sua densità diminuisce a 0,92 g/cm3 - è a causa di questa differenza di densità che il ghiaccio galleggia sull'acqua.
 Il ghiaccio galleggia sull'acqua perché la sua densità è inferiore allo stato solido che allo stato liquido.
Il ghiaccio galleggia sull'acqua perché la sua densità è inferiore allo stato solido che allo stato liquido.
Esempi pratici di densità
Per capire in pratica che cos'è la densità immagina due contenitori, uno con 1 kg di piombo e l'altro con 1 kg di cotone. Entrambi hanno la stessa massa, cioè 1 chilo.
Tuttavia, poiché il cotone è molto più leggero del piombo, è necessaria una quantità molto maggiore di questo materiale per uniformare le masse di entrambi i contenitori.
Pertanto, lo spazio occupato dal cotone sarà molto più grande dello spazio occupato dal piombo. Ciò significa che il piombo ha una quantità di materia concentrata molto maggiore e quindi una densità maggiore rispetto al cotone.
Ora vediamo altri esempi di situazioni pratiche spiegate dalla differenza di densità dei materiali:
Cubetti di ghiaccio
Se posti in un bicchiere d'acqua, i cubetti di ghiaccio galleggiano a causa della loro densità (0,92 g/cm)3) è inferiore alla densità dell'acqua (1g/cm3).
Quando i cubetti di ghiaccio vengono posti in un bicchiere di alcol, i cubetti di ghiaccio affonderanno a causa della loro densità (0,92 g/cm)3) è maggiore della densità dell'etanolo (0,79 g/cm3).
 Il ghiaccio affonda in un bicchiere di bevanda alcolica perché la densità dell'alcol è inferiore a quella dell'acqua.
Il ghiaccio affonda in un bicchiere di bevanda alcolica perché la densità dell'alcol è inferiore a quella dell'acqua.
Polistirolo e unghie and
Un altro esempio che aiuta a capire la densità è osservare il comportamento di una tavola di polistirolo e di un chiodo in acciaio quando vengono posti in acqua.
L'unghia affonda subito perché la sua densità (0,78 g/m2)3) è molto maggiore della densità dell'acqua. Ciò significa che l'acciaio ha una grande quantità di materia concentrata in un piccolo volume.
D'altra parte, quando il pannello di polistirolo viene immerso nell'acqua, galleggia perché la densità del polistirolo è inferiore alla densità dell'acqua. A differenza dell'acciaio, il polistirolo è una sostanza che ha poca materia concentrata.
 La densità del polistirolo è inferiore a quella dell'acqua, quindi la tavola galleggia.
La densità del polistirolo è inferiore a quella dell'acqua, quindi la tavola galleggia.
Massa specifica e densità
La densità è anche usata per riferirsi alla densità, ma non sempre possono essere intese come sinonimi.
IL densità si riferisce ad a corpo, che può essere composto da una sola sostanza o da una miscela di sostanze, come una soluzione di acqua con zucchero.
IL Massa specifica, a sua volta, si riferisce alla densità di a sostanza omogenea specifici, come alluminio, piombo o acqua.
Ciò significa che quando un corpo è composto da una sola sostanza, la sua densità è data dalla sua massa specifica. Tuttavia, quando il corpo è eterogeneo, sarà necessario calcolare la sua densità come rapporto tra massa e volume.
Densità della sostanza
Vedere la densità (o massa specifica) di alcune sostanze nella tabella seguente:
| Sostanza | Densità |
|---|---|
| acqua | 1,0 |
| Aria | 1,2 |
| Acciaio | 7,8 |
| Alluminio | 2,7 |
| Condurre | 11,3 |
| Rame | 8,9 |
| etanolo | 0,79 |
| Ferro | 7,86 |
| Ghiaccio | 0,92 |
| Latte | 1,03 |
| legna | 0,5 |
| Oro | 19,3 |
Densità assoluta e densità relativa
La densità assoluta si riferisce alla densità di un dato corpo o sostanza. La densità relativa, a sua volta, è la densità di un materiale rispetto a un altro.
Il calcolo della densità relativa è il rapporto tra le due densità, che si calcolano dividendo la massa per il volume. La formula della densità può essere espressa da:
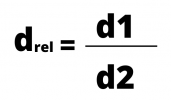
o
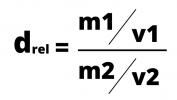
La densità relativa viene spesso utilizzata per confrontare la densità delle sostanze rispetto all'acqua, la cui densità è 1 g/cm3.
Densità unità di misura
L'unità di misura utilizzata nel Sistema Internazionale (SI) è kg/m3, ma è comune trovare questa grandezza espressa anche in g/cm3 e g/ml. La relazione tra queste unità di misura è:
1 g/cm3 = 1 g/ml = 1000 kg/m3
Vedi anche il significato di chimica e misure di volume.

