isomeria è un fenomeno naturale in cui sostanze diverse (in termini di proprietà chimiche e fisiche) hanno esattamente la stessa formula molecolare, come nell'esempio seguente:
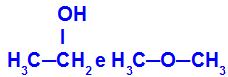
Sostanze diverse che hanno la stessa formula molecolare
L'etanolo (a sinistra) ha la formula molecolare C2H6O, che si verifica anche con metossietano (a destra), quindi sono isomeri.
Tipi di isomeria
→ isomero piatto
È il tipo di isomeria che studia le differenze strutturali tra gli isomeri.
Il) Occupazione
È il tipo di isomeria piatta in cui la differenza tra le sostanze si basa sulla differenza tra le funzioni organiche a cui appartengono. Vedi alcuni esempi:
Propanone e propano:
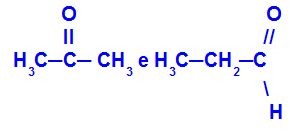
Isomeri appartenenti a funzioni diverse
Il propanone (a sinistra) appartiene al gruppo dei chetoni e il propanale (a destra) al gruppo delle aldeidi.
B) Prigione
È il tipo di isomeria piatta in cui la differenza tra le sostanze si basa sulla differenza tra le catene che presentano. Vedi un esempio:
2-metil-propano e butano
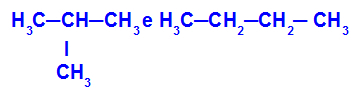
Isomeri che hanno catene con classificazioni differenti
Nell'esempio, possiamo vedere che il 2-metil-propano (a sinistra) ha una catena ramificata e il butano (a destra) ha una catena normale.
ç) Posizione
È il tipo di isomeria piatta in cui la differenza tra sostanze si basa sulla differenza di posizione di un componente presente nelle loro catene. Vedi un esempio:
1-cloro-propano e 2-cloro-propano
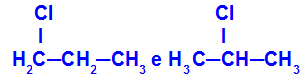
Isomeri che hanno componenti in posizioni diverse nella catena
Nell'esempio possiamo vedere che l'1-cloro-propano (a sinistra) ha il cloro posizionato sul carbonio 1 e il 2-cloro-propano (a destra) ha il cloro posizionato sul carbonio 2.
d) Metameria o compensazione
NOTA: Isomeria valida esclusivamente per stringhe eterogenee.
È il tipo di isomeria piatta in cui la differenza tra le sostanze si basa sulla differenza di posizione di un eteroatomo presente nelle loro catene. Vedi un esempio:
Esempio: Metossipropano ed Etossietano
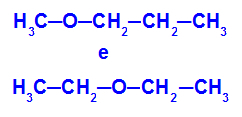
Isomeri che hanno eteroatomi in posizioni diverse nella catena
Nell'esempio, possiamo vedere che, nel metossipropano (a sinistra), l'ossigeno ha un radicale con un carbonio da un lato e tre atomi di carbonio dall'altro. Nell'etossietano (a destra), l'ossigeno ha un radicale con due atomi di carbonio da un lato e due atomi di carbonio dall'altro.
e)Tautomeria
È un caso particolare di isomeria a funzione piana e si verifica in sole tre funzioni organiche:
Aldeide
chetone
Enol
Questo tipo di isomeria funziona sul fatto che esiste un equilibrio chimico tra un enolo e un'aldeide e tra un enolo e un chetone, cioè questi componenti vengono costantemente convertiti l'uno nell'altro. Vedi un esempio:
Prop-2-en-1-olo e propanone
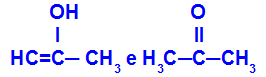
Isomeri appartenenti a funzioni diverse
Nell'esempio, possiamo vedere che Prop-2-en-1-olo (a sinistra) appartiene al gruppo degli enoli e il propanone (a destra) appartiene al gruppo dei chetoni, quindi sono isomeri della tautomeria.
→ Isomeria spaziale
È un tipo di isomeria definito dall'analisi spaziale della molecola.
a) Isomeri geometrici
Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
È un tipo di isomeria spaziale che si verifica quando la sostanza ha molecole con le seguenti caratteristiche:
Catena chiusa che ha due atomi di carbonio con due diversi ligandi, come nell'esempio seguente:

Struttura chiusa con isomeria geometrica
Catena aperta che ha un doppio legame tra i carboni e, in ciascuno di questi carboni del doppio legame, sono presenti due diversi ligandi, come nell'esempio seguente:
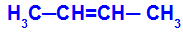
Struttura aperta con isomeria geometrica
L'isomerismo geometrico è diviso in due gruppi:
1oh Gruppo: cis-trans
Si verifica quando i due ligandi di un carbonio sono strettamente uguali ai due ligandi dell'altro carbonio, sia nella struttura aperta che nella struttura chiusa.
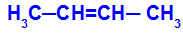
Catena di una sostanza che ha isomeria cis-trans
L'isomero si chiamerà cis quando gli stessi ligandi si trovano sullo stesso piano.

Esempio di un isomero cis
L'isomero sarà chiamato trans quando i diversi ligandi si trovano sullo stesso piano.

Esempio di un isomero trans
2oh Gruppo: E-Z
Si verifica quando i due ligandi di un carbonio sono diversi rispetto ai due ligandi dell'altro carbonio, sia nella struttura aperta che nella struttura chiusa.

Catena di una sostanza che ha isomeria E-Z
L'isomero si chiamerà E quando i leganti con il numero atomico più alto si trovano su piani opposti. Nell'esempio sotto, il carbonio a sinistra ha il Br con il numero atomico più alto (35) e, nell'altro, c'è l'ossigeno (8).
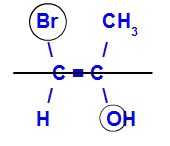
Esempio di un isomero E
L'isomero si chiamerà Z quando i leganti con il numero atomico più alto si trovano sullo stesso piano. Nell'esempio sotto, il carbonio a sinistra ha il Br con il numero atomico più alto (35) e, nell'altro, c'è l'ossigeno (8).

Esempio di un isomero Z
B) isomero ottico
È un tipo di isomeria spaziale che si verifica solo se la sostanza ha molecole con carbonio chirale (quello che ha quattro diversi ligandi) nelle loro strutture. La molecola con carbonio chirale ha la capacità di polarizzare e deviare la luce, come segue:
A destra (isomero di destra)
A sinistra (isomero levogiro)
Un composto con attività ottica ha sempre isomeri attivi (detti antipodi ottici) e isomeri inattivi (miscela tra due isomeri attivi, una miscela detta racemica).
Possiamo usare la seguente formula per determinare il numero di isomeri attivi (IOA) e inattivi (IOI) di un composto che ha carbonio chirale:
IOA = 2no
IOI = 2no
2
Di seguito è riportato un esempio di un composto con isomeria geometrica:
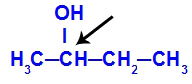
Carbonio chirale presente in butan-2-ol
La struttura del butan-2-olo ha i seguenti ligandi:
metile (CH3)
Etile (CH3-CH2)
Idrogeno (H)
Idrossile (OH)
Poiché ha un solo carbonio chirale, quindi, il butan-2-olo ha:
Isomeri attivi:
IOA = 21
IOA = 2
Isomeri inattivi:
IOI = 21
2
IOI = 2
2
IOI = 1
Di Me. Diogo Lopes Dias
Vorresti fare riferimento a questo testo in un lavoro scolastico o accademico? Guarda:
GIORNI, Diogo Lopes. "Cos'è l'isomerismo?"; Scuola Brasile. Disponibile in: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-isomeria.htm. Consultato il 27 giugno 2021.


