In una trasformazione isotermica, il variazione di volume e pressione di un certo gas, ma il temperatura costante; da qui l'origine del nome isotermico (dal greco: iso = uguale; termo = calore).
Gli scienziati Boyle e Mariotte, da soli, hanno condotto esperimenti simili e il risultato ottenuto è stato: all'aumentare della pressione, il volume del gas diminuisce.
Basti pensare, ad esempio, allo stantuffo di una siringa. Se applichiamo una pressione esterna su questo stantuffo, cioè se aumentiamo la pressione, il volume d'aria occupato all'interno della siringa diminuirà e viceversa.
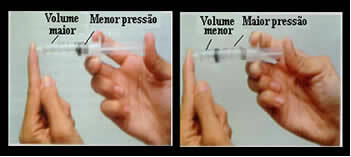
Volume e pressione sono inversamente proporzionali: nel pannello di sinistra la pressione è piccola e il volume occupato dall'aria è grande. A destra, quando viene applicata più pressione allo stantuffo della siringa, il volume diminuisce.
Non si tratta di un caso isolato, è qualcosa che si ripete con regolarità comune per i gas. Pertanto, questo fatto è stato affermato sotto forma di una legge, che può essere descritta come segue:
| legge di Boyle o Legge di Boyle-Mariotte: A temperatura costante, il volume occupato da una massa fissa di un gas è inversamente proporzionale alla sua pressione. |
Ciò significa che se raddoppiamo la pressione di un gas, il suo volume si dimezza e così via. Quando due di tali quantità sono inversamente proporzionali, il loro prodotto è una costante; quindi, matematicamente, questa relazione può essere rappresentata come segue:
Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
| P.V = k |
Dove k = costante.
Quindi, se in una prima situazione abbiamo il valore di pressione di un certo gas come P1 e il suo rispettivo volume come V1, allora dobbiamo:
| P1. V1 = k |
Se aumentiamo questa pressione a P2, anche il suo volume verrà modificato in V2 e di nuovo dovremo:
| P2 . V2 = k |
Quindi, arriviamo alla conclusione:
| P1. V1 =P2. V2 |
Questa costanza può essere vista dall'esempio riportato nella tabella seguente, delle pressioni e dei volumi di un gas con una massa fissa:
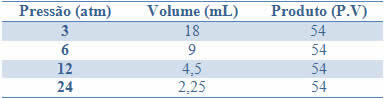
Rappresentando graficamente questi valori, vedremo la formazione di una curva.
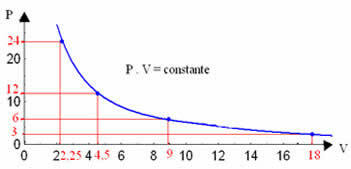
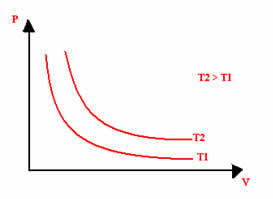
La rappresentazione grafica di una trasformazione isotermica sarà sempre un'iperbole, indipendentemente dai valori di pressione e volume e temperatura a cui è stato effettuato l'esperimento. Questa iperbole si chiama isoterma; quindi, come si può vedere nel grafico sottostante, diverse temperature danno luogo a diverse isoterme.
Vorresti fare riferimento a questo testo in un lavoro scolastico o accademico? Guarda:
FOGAÇA, Jennifer Rocha Vargas. "Trasformazione isotermica o legge di Boyle"; Scuola Brasile. Disponibile in: https://brasilescola.uol.com.br/quimica/transformacao-isotermica-ou-lei-boyle.htm. Consultato il 27 giugno 2021.


