A molecole sono strutture che hanno una determinata massa molare e un numero relativamente piccolo ed esatto di atomi legati tra loro in modo covalente, cioè attraverso la condivisione di elettroni.
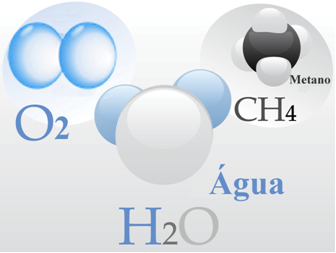
Vedi tre esempi:
- Gas di ossigeno: Le sue molecole sono formate ciascuna da un doppio legame, cioè dalla condivisione di due coppie di elettroni tra due atomi di ossigeno (O2);
- Acqua: è formata da molecole di H2O. Ciò significa che ogni molecola ha due atomi di idrogeno che condividono una coppia di elettroni ciascuno con un atomo di ossigeno.
- Metano: questo composto è formato da molecole di CH4, in cui quattro atomi di idrogeno si legano covalentemente a un atomo di carbonio.
Le sostanze molecolari hanno alcune proprietà caratteristiche, come:
- Solubilità varia in acqua e altri solventi;
- Possono presentarsi nei tre stati fisici;
- In generale, sono isolanti elettrici, sia solidi che liquidi.
Tutte le molecole sono formate da elementi non metallici, cioè includono solo idrogeno, non metalli e semimetalli. Ma questi elementi possono anche formare sostanze che sono presenti solo allo stato solido e che hanno proprietà molto diverse da quelle delle molecole. queste sono le
macromolecole.Macromolecole, note anche come solidi covalenti o solidi reticolari covalenti,sono strutture con una massa molare molto elevata e imprecisa, oltre ad essere formate da una grande e indeterminata quantità di atomi che si legano covalentemente a formare reticoli tridimensionali. Le macromolecole formano il cristalli covalenti o cristalli atomici.
Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
Ad esempio, gli atomi di carbonio possono condividere gli elettroni in molti modi e formare molte diverse sostanze semplici. Questa proprietà che lo stesso elemento chimico ha di formare due o più sostanze semplici differenti prende il nome di allotropia.
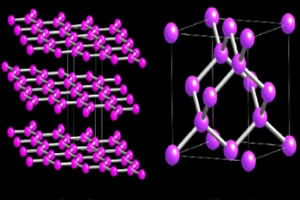
Due varietà allotropiche di carbonio che formano macromolecole sono le Diamante e il grafite. Nelle immagini sottostanti si può notare che, nel caso del diamante, ogni atomo di carbonio si lega ad altri quattro atomi di carbonio e dà origine ad una macromolecola a struttura tetraedrica.

Nel frattempo, la struttura della grafite è formata da anelli esagonali contenuti nello stesso piano. Gli atomi di carbonio formano un legame doppio e due singoli.

Ma le macromolecole non sono costituite solo da un singolo tipo di elemento; possono anche essere formati da atomi di diversi elementi chimici.
Un esempio è il biossido di silicio (quarzo), le cui macromolecole hanno ciascun atomo di silicio circondato da quattro atomi di carbonio e ciascun atomo di ossigeno legato a due atomi di silicio.
di Jennifer Fogaça
Laureato in Chimica
Vorresti fare riferimento a questo testo in un lavoro scolastico o accademico? Guarda:
FOGAÇA, Jennifer Rocha Vargas. "Molecole e Macromolecole"; Scuola Brasile. Disponibile in: https://brasilescola.uol.com.br/quimica/moleculas-macromoleculas.htm. Consultato il 28 giugno 2021.
Chimica
Cos'è l'allotropia, le sostanze semplici, l'ossigeno gassoso, l'ozono, le forme allotropiche, l'ossigeno dell'elemento chimico, i raggi ultravioletti del sole, il diamante, la grafite, l'atomicità, il fosforo bianco.
Formula spaziale di carbonio, formula elettronica di Lewis, struttura piana, coppie elettroniche, legame covalente, strato di valenza, evoluzione del modello atomico, formula molecolare, formula strutturale, formule tridimensionale.
Formule chimiche, formula strutturale piatta, formula strutturale Couper, triplo legame, gas azoto, formula elettronica, formula di Lewis, formula molecolare, legame singolo, doppio legame, gas carbonico.


