Diciamo che abbiamo tre cucchiai. Nella prima mettiamo 5 gocce d'acqua; nella seconda mettiamo 5 gocce di alcool e nella terza 5 gocce di acetone. Dopo aver atteso un po', vedremo che l'acetone si trasformerà rapidamente in uno stato gassoso, seguito dall'alcol, e solo dopo molto tempo l'acqua evapora.
Questo esempio ci mostra che le sostanze non vanno allo stato gassoso o allo stato di vapore contemporaneamente e, di conseguenza, anche i loro punti di ebollizione sono diversi.
Per capire perché ciò accade, dobbiamo prima capire quando avviene questa transizione da liquido a gas (oa vapore nel caso dell'acqua). Le molecole di liquidi in un contenitore sono costantemente in agitazione, poiché hanno una certa libertà di movimento. La pressione atmosferica esercita su queste molecole una forza che impedisce loro di passare allo stato gassoso. Inoltre, le molecole creano legami intermolecolari tra loro, che rendono anche difficile cambiare il loro stato fisico.
Tuttavia, quando queste molecole acquisiscono una determinata energia cinetica riescono a rompere i loro legami intermolecolari e la loro inerzia, passando allo stato gassoso o di vapore.
Quando aumentiamo la temperatura di questo liquido, stiamo fornendo energia al sistema, che provoca questi le molecole acquisiscono più rapidamente l'energia necessaria per cambiare stato, cosa che avviene quando raggiungono la il tuo punto di ebollizione.
Nel caso dell'esempio riportato, i punti di ebollizione dell'acetone, dell'alcol e dell'acqua sono rispettivamente 56,2 °C, 78,5 °C e 100 °C a livello del mare. Questo spiega l'ordine di evaporazione menzionato per questi liquidi.
Ma perché questa differenza?
Ci sono due fattori fondamentali che giustificano le differenze nei punti di ebollizione delle sostanze, che sono: interazioni intermolecolari e masse molari.
Diamo un'occhiata al seguente elenco per vedere come questi fattori influenzano il punto di ebollizione delle sostanze:

- Interazioni intermolecolari:

Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
Se l'interazione intermolecolare è intensa, sarà necessario fornire ancora più energia al sistema affinché si scomponga e la molecola possa passare allo stato gassoso.
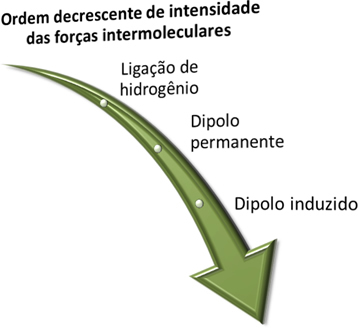
L'intensità di queste interazioni tra le molecole segue il seguente ordine decrescente:
Legami idrogeno > dipolo permanente > dipolo indotto
Ad esempio, nella tabella, vediamo che i punti di ebollizione del butan-1-olo e dell'acido etanoico sono superiori a quelli di altre sostanze. Questo perché queste due sostanze hanno legami idrogeno, che sono interazioni più intense delle altre.
Inoltre, il punto di ebollizione del propanone è superiore a quello del pentano perché l'interazione del propanone è dipolo permanente, che è più intenso del dipolo indotto, che è l'interazione eseguita dal pentano.
Ma perché il punto di ebollizione del propanone non è superiore a quello dell'esano, dal momento che svolge anche l'interazione dipolo indotto?
È qui che entra in gioco il secondo fattore che interferisce con il punto di ebollizione di una sostanza: la massa molare.
- Masse molari:

Se la massa della molecola è grande, sarà necessario fornire più energia al sistema in modo che la molecola possa superare l'inerzia e passare allo stato gassoso.
Ad esempio, pentano ed esano svolgono la stessa interazione, che è quella di un dipolo indotto, ma la massa molare dell'esano è maggiore. Pertanto, il punto di ebollizione dell'esano è superiore a quello del pentano.
Nel caso del butan-1olo e dell'acido etanoico, entrambi formano legami idrogeno e il butan-1-olo ha una massa molare maggiore. Tuttavia, il punto di ebollizione dell'acido etanoico è più alto perché due molecole di acido etanoico possono formare due legami tra loro. idrogeno (tramite i gruppi O e OH), mentre due molecole di butan-1-olo stabiliscono tra loro un solo legame idrogeno (tramite il gruppo OH).
di Jennifer Fogaça
Laureato in Chimica
Vorresti fare riferimento a questo testo in un lavoro scolastico o accademico? Guarda:
FOGAÇA, Jennifer Rocha Vargas. "Confronto tra punti di ebollizione di sostanze"; Scuola Brasile. Disponibile in: https://brasilescola.uol.com.br/quimica/comparacao-entre-pontos-ebulicao-das-substancias.htm. Consultato il 27 giugno 2021.
c) ( ) La solubilità dello zucchero in acqua è dovuta alla costituzione di legami idrogeno tra saccarosio e molecole d'acqua.