A forze intermolecolari sono forze di attrazione elettrostatica la cui funzione è di unire molecole (composti molecolari), mantenendole allo stato solido o liquido. Sono estremamente importanti, poiché determinano tutte le proprietà fisiche (punto di fusione, punto di ebollizione, densità e solubilità) di sostanze.
In questo testo studieremo il relazione tra le forze intermolecolari e il punto di ebollizione delle sostanze. Inizialmente, ricordiamo tre importanti tipi di forze intermolecolari, che sono:
♦ dipolo dipolo: è la forza che si manifesta nelle molecole polari. Poiché queste molecole hanno un polo positivo e uno negativo, la forza dipolo-dipolo si basa sull'attrazione tra l'estremità positiva di una molecola e l'estremità negativa di un'altra. Esempi: HCl, HBr, SO2 e PH3
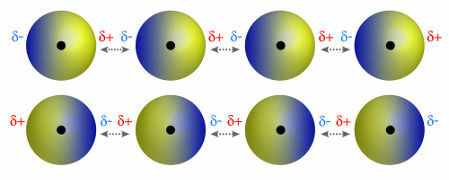
Molecole che hanno un polo positivo e negativo che si attraggono
♦ dipolo indotto: è la forza intermolecolare che si verifica solo nelle molecole non polari (non hanno poli). Quando due molecole apolari si avvicinano, si verifica una deformazione momentanea delle loro nuvole elettroni, che provoca uno squilibrio negli elettroni della molecola, che sono distribuiti in a diverso per lei. In quel momento si crea un dipolo momentaneo e la molecola ha momentaneamente un polo positivo e uno negativo, che provoca l'attrazione. Esempi: CO
2, CH4 e BH3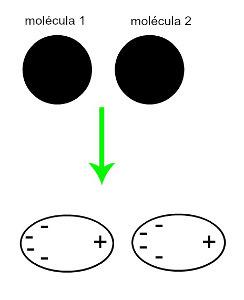
L'approssimazione di due molecole apolari genera una deformazione e, di conseguenza, una ridistribuzione degli elettroni, che forma i dipoli momentanei
♦ Legami di idrogeno: è la forza intermolecolare che si verifica nelle molecole polari, ma solo in quelle che hanno obbligatoriamente atomi di idrogeno legati direttamente con atomi di fluoro, ossigeno o azoto. Può essere considerata una forza dipolo-dipolo, ma di intensità molto maggiore. L'interazione avviene sempre tra l'idrogeno di una molecola e il diverso atomo (F, O, N) di un'altra molecola. Esempi: H2O, NH3 e HF
Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
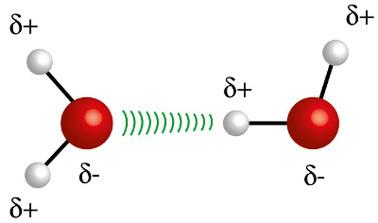
L'atomo di idrogeno (sfera bianca) di una molecola interagisce con l'ossigeno (sfera rossa) di un'altra molecola d'acqua
Avendo ricordato le tre forze intermolecolari, possiamo ora metterle in relazione con il punto di ebollizione delle sostanze. è chiamato punto di ebollizione la temperatura alla quale le molecole di una data sostanza cessano di essere allo stato liquido (si rompono le loro forze intermolecolari) e passano allo stato gassoso. Il dettaglio interessante è che il forze intermolecolari e punto di ebollizione di sostanze hanno un rapporto molto intenso e diretto, poiché più intensa è la forza intermolecolare, maggiore è il punto di ebollizione. L'ordine di intensità delle forze intermolecolari è:
Dipolo indotto < Dipolo-dipolo < Legami a idrogeno
Quindi, possiamo concludere che le molecole che hanno legami idrogeno come forza di interazione hanno punti di ebollizione più alti di quelle che hanno dipolo-dipolo e così via. La tabella seguente mostra tre sostanze e i loro valori di punto di ebollizione:
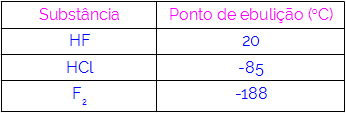
Osserviamo nella tabella che l'HF ha un punto di ebollizione più alto, poiché le sue molecole sono unite da legami idrogeno. Sostanza F2 ha il punto di ebollizione più basso, poiché le sue molecole sono attratte da un dipolo indotto.
Di Me. Diogo Lopes Dias
Vorresti fare riferimento a questo testo in un lavoro scolastico o accademico? Guarda:
GIORNI, Diogo Lopes. "Forze intermolecolari e punto di ebollizione delle sostanze"; Scuola Brasile. Disponibile in: https://brasilescola.uol.com.br/quimica/forcas-intermoleculares-ponto-ebulicao-das-substancias.htm. Consultato il 27 giugno 2021.
Chimica
Sostanze molecolari, temperatura di ebollizione, superficie di contatto, punto di ebollizione, forze di attrazione intermolecolari, legame chimico, composti molecolari, legami chimici covalenti, legami ionici, legami metallici, stati fisici di cattivo