l'atomo è il unità di base della materia, cioè la porzione più piccola in cui un elemento può essere suddiviso senza perdere le sue proprietà chimiche.
Gli atomi sono formati da un nucleo composto da particelle di protoni e neutroni ed elettroni che orbitano attorno al nucleo, formando l'elettrosfera.
La parola atomo è di origine greca e significa "indivisibile". Fino al XIX secolo si credeva che l'atomo fosse la parte più piccola della materia, cioè che sarebbe stato impossibile dividerlo.
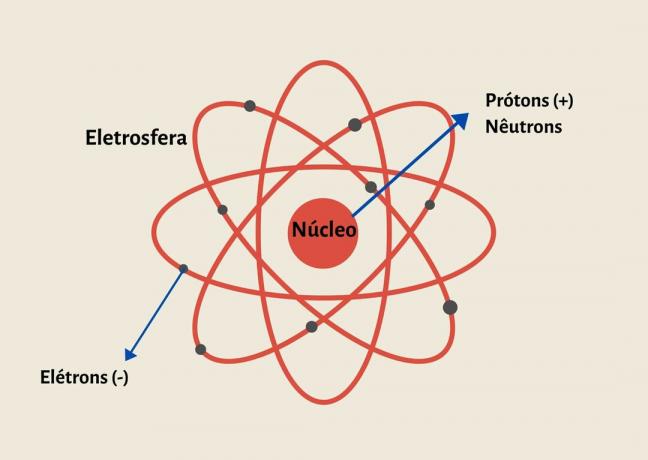
Un atomo è formato da protoni e neutroni nel nucleo ed elettroni nell'elettrosfera.
Struttura e composizione di un atomo
Gli atomi sono pezzi di materia molto piccoli, così piccoli che non possono essere visti con i normali microscopi.
La sua struttura è formata da un nucleo infinitamente piccolo e denso, composto da protoni e neutroni, e da un'elettrosfera composta da elettroni.
- Protoni (p): particelle positive e con massa unitaria.
- Neutroni (n): particelle neutre (non cariche) e con massa unitaria.
- Elettroni (e): particelle negative e praticamente prive di massa in costante movimento orbitale attorno al nucleo.
Il nucleo rappresenta il 99,9% della massa di un atomo. La massa degli elettroni è praticamente irrilevante: un elettrone ha una massa 1836 volte inferiore alla massa dei protoni e dei neutroni.
Il movimento degli elettroni attorno al nucleo forma a campo elettromagnetico. Gli elettroni orbitano attorno al nucleo a una velocità così elevata che, se si potesse vedere l'atomo, l'elettrosfera sarebbe vista come una nuvola attorno al nucleo.
Gli atomi sono elettricamente neutri - hanno lo stesso valore assoluto dei protoni (+) e degli elettroni (-), quindi la loro carica diventa zero.
Se un atomo riceve o perde elettroni, cessa di essere un atomo e diventa a ione, che può avere carica positiva o negativa:
- Se riceve elettroni, si carica negativamente e diventa a anione.
- Se perde elettroni, si carica positivamente e diventa a cazione.
capire di cosa si tratta importa e scopri di più sul cationi e anioni.
Struttura dell'elettrosfera
L'elettrosfera è formata da elettroni in moto orbitale, ma questi elettroni non sono disposti casualmente, ci sono strati elettronici dove queste particelle sono distribuite.
Un atomo può avere fino a sette strati elettronici. Ciascuno di questi strati ha diversi livelli di energia, con lo strato più esterno che è lo strato più energetico.
Questi livelli sono rappresentati dalle seguenti lettere: K, L, M, N, O, P, Q. K è lo strato più vicino al nucleo.
Non tutti gli atomi hanno 7 strati, il mercurio, ad esempio, ne ha solo 6. Ma indipendentemente dal numero di gusci, è regola che l'ultimo non può avere più di 8 elettroni.
Gli strati elettronici sono ulteriormente suddivisi in sottolivelli energetici, rappresentato dalle lettere: s, p, d, f.
Storia dell'atomo e modelli atomici
L'idea che la materia potesse essere divisa in piccole parti fino a raggiungere un'unità così piccola da non poter più essere divisa esisteva fin dai tempi dell'antica Grecia.
Democrito, intorno al 400 aC C., fu il primo scienziato a postulare l'esistenza di questa piccola particella e la chiamò “atomo”, che in greco significa “indivisibile”.
Fu nel 1803 che fu sviluppata la prima teoria coerente degli atomi. John Dalton sosteneva che l'atomo era la parte più piccola della materia e che era indivisibile.
Nei secoli successivi, con lo sviluppo della scienza e della tecnologia, nuove scoperte su questa particella furono fatte e postulate in diversi modelli atomici.
1803 - Modello Dalton
Sviluppato dal professor John Dalton nel 1803, questo modello divenne noto come il modello del "palla da biliardo", perché secondo lui gli atomi erano sfere massicce, indivisibili e indistruttibili.

1898 - Modello Thomson
Joseph Thomson scoprì l'esistenza degli elettroni e, secondo il suo modello, queste cariche sarebbero distribuite uniformemente in tutto l'atomo, con cariche positive.
L'atomo nel modello di Thomson era sferico anziché massiccio e divenne noto come "budino all'uvetta", dove l'uvetta in un budino rappresentava le cariche positive e negative.

1911 - Modello Rutherford
Rutherford fece un'importante scoperta sull'atomo: l'esistenza di un nucleo. Il suo modello diceva che l'atomo era costituito da un nucleo e da un'elettrosfera.
Nel nucleo ci sarebbero i protoni ei neutroni e nell'elettrosfera gli elettroni. Questo modello divenne noto come "sistema solare".
Quello che Rutherford non riusciva a spiegare era come gli elettroni non collassassero con il nucleo dell'atomo.

1913 - Modello Rutherford-Bohr
Il modello di Rutherford fu integrato con le scoperte fatte dal fisico Niels Bohr nel 1913. Bohr giunse alla conclusione che gli elettroni orbitano attorno all'elettrosfera in strati di diversi livelli di energia.
Gli elettroni non assorbono o rilasciano energia in questo movimento, quindi rimangono in un'orbita a energia costante, che impedisce loro di scontrarsi con il nucleo.

Caratteristiche di un atomo
Ciò che differenzia un atomo da un altro è la quantità di protoni, neutroni ed elettroni nella sua composizione. I valori principali utilizzati per identificare gli atomi sono massa atomica e numero atomico.
massa atomica
Il valore della massa atomica è rappresentato dalla somma dei protoni e dei neutroni presenti nel nucleo dell'atomo.
A = z + n
numero atomico
Il numero atomico è il numero di protoni nel nucleo di un atomo, il suo valore è rappresentato dalla lettera z. Poiché in un atomo il numero di protoni è uguale al numero di elettroni, abbiamo:
z = p = e
L'insieme di più atomi con lo stesso numero atomico forma a elemento chimico. Tutti gli elementi chimici conosciuti sono rappresentati sulla tavola periodica seguendo un ordine crescente di numero atomico.
Gli elementi chimici sono rappresentati nella tavola periodica dal loro acronimo e nome al centro, dalla massa atomica in basso e dal numero atomico in alto, come mostrato nell'immagine:

- Massa atomica = 196.967
- Numero atomico = 79
Atomi e molecole
Un atomo è una piccolissima porzione di materia, è composto da un nucleo con protoni e neutroni ed elettroni che ruotano attorno al nucleo.
Una molecola è un raggruppamento di atomi di elementi uguali o diversi, che insieme formano una sostanza. Per esempio:
- Due atomi di ossigeno si uniscono e formano una molecola di ossigeno (O2).
- Due atomi di idrogeno si uniscono con un atomo di ossigeno e formano una molecola d'acqua (H2O).
Vedi anche:
- molecole
- Diagramma di Linus Pauling
