La polarità di un legame e di una molecola è correlata alla distribuzione degli elettroni attorno agli atomi.Se questa distribuzione è simmetrica, la molecola sarà non polare, ma se è asimmetrica, e una delle parti della molecola ha una maggiore densità elettronica, quindi è una molecola polare.
La polarità delle molecole può essere visualizzata quando la loro sostanza costitutiva è soggetta a un campo elettrico esterno. Se le molecole si orientano in presenza di questo campo, cioè, se una parte è attratta dal polo positivo e l'altra parte della molecola è attratta dal polo negativo, allora, sono polari. Altrimenti, se non si orientano, sono apolari.
Ad esempio, quando strofini molto un bastoncino di vetro con una flanella, si carica positivamente. Se lo avviciniamo ad un getto d'acqua che cade da un rubinetto, vedremo che l'acqua non continuerà a cadere in una traiettoria verticale diritta, ma sarà attratta dal bastone, subendo una deviazione. Questo dimostra che l'acqua è polare. Ma se facciamo lo stesso esperimento con un filetto d'olio, non devierà nella sua traiettoria, dimostrando che le sue molecole non sono polari.
Analizzando le strutture delle molecole, possiamo determinare se sono polari o meno, tenendo conto di due importanti fattori: la differenza di elettronegatività tra gli atomi e la geometria della molecola.
1°) Elettronegatività tra atomi:
Se la molecola è formata da legami tra atomi degli stessi elementi chimici, cioè se sono sostanze semplici come O2, H2, no2, Cℓ2, P4, S8, ecc., saranno non polari, perché non c'è differenza di elettronegatività tra i loro atomi.
L'unica eccezione è la molecola di ozono (O3), che si vedrà in seguito.
Se la molecola è biatomica e formata da elementi di diversa elettronegatività, allora la molecola sarà polare. Esempi: HCℓ, HF, HBr e HI.
2°) Geometria della molecola:
La geometria della molecola influenza la distribuzione degli elettroni in essa e, di conseguenza, la sua polarità. Se la molecola è composta da tre o più atomi, dovremo analizzare ogni legame che si forma e la geometria della molecola. Vedi un esempio: CO2 – molecola lineare:
δ- δ+ δ-
O = C = O
Nota che l'ossigeno è più elettronegativo del carbonio, quindi gli elettroni di legame sono più attratti dall'ossigeno. In essi si forma una parziale carica negativa (δ-), mentre nel carbonio si forma una parziale carica positiva (δ+). La moltiplicazione della distanza tra i nuclei degli atomi legati con queste cariche in modulo (cioè solo il numero senza segno più o meno) si chiama momento di dipolo ed è rappresentato da μ.
μ = d. |δ|
Questo momento di dipolo è indicato da frecce che puntano nella direzione dell'elemento più elettronegativo, che attrae gli elettroni: O ← C → O. Ciò mostra che questa quantità è un vettore (una quantità che ha una grandezza o intensità, direzione e direzione). Pertanto, è meglio rappresentato da:  .
.

Sommando tutti i vettori, troviamo il momento di dipolo risultante, 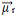 , che in questo caso era uguale a zero perché i due momenti di dipolo hanno valori uguali, ma vanno in direzioni opposte, annullandosi a vicenda.
, che in questo caso era uguale a zero perché i due momenti di dipolo hanno valori uguali, ma vanno in direzioni opposte, annullandosi a vicenda.
Quando il vettore del momento dipolare risultante è uguale a zero, la molecola è non polare, ma se è diversa da zero, sarà polare.
Pertanto, nel caso della molecola di CO2, lei è apolare.
Ora guarda un altro esempio: H2O - geometria angolare (perché l'ossigeno ha due coppie di elettroni disponibili al livello più esterno, che respingono gli elettroni dai legami con gli idrogeni):
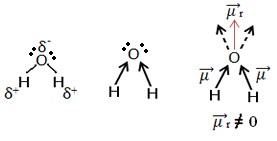
Gli elettroni sono attratti dall'ossigeno. Ma, in questo caso, i vettori non si annullano a vicenda, perché la geometria molecolare dell'acqua è angolare, poiché le sue direzioni non sono opposti, dando un vettore momento dipolo risultante diverso da zero, e quindi la molecola d'acqua è polare.
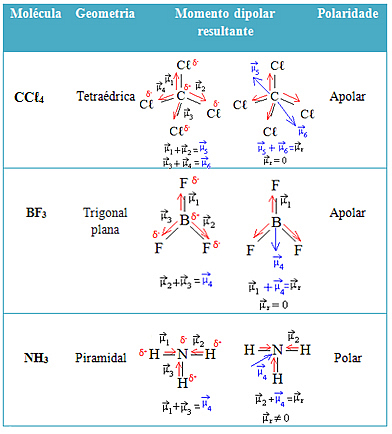
Vedi altri esempi nella tabella seguente:
di Jennifer Fogaça
Laureato in Chimica
Fonte: Scuola Brasile - https://brasilescola.uol.com.br/quimica/polaridade-das-moleculas.htm


