Ibridazione del carbonio di tipo sp2 si verifica quando ha un doppio legame e due legami singoli o un legame pi greco (π) e tre legami sigma (σ). Infatti, l'ibridazione sp2 si realizza tra gli atomi che stabiliscono il doppio legame.
Un esempio di tale molecola è la formaldeide (CH2O). Notare la sua struttura di seguito:
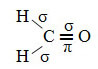
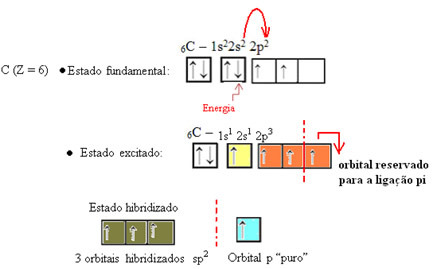
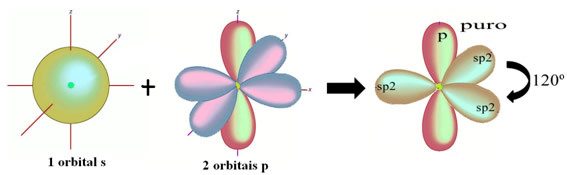
Come si vede nel testo"ibridazione di tipo sp3”, l'ibridazione del carbonio si verifica quando un elettrone dal sottolivello 2s riceve energia e viene "trasportato" al sottolivello 2p e, quindi, originano 4 orbitali ibridati dal "mix" di orbitali atomici puro.
Nel caso della formaldeide, sappiamo che ci sarà un legame pi greco, quindi uno di questi orbitali ibridati è riservato a questo legame, mentre gli altri tre portano i legami sigma:
Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
Gli atomi di idrogeno che formano il legame singolo con il carbonio, lo fanno con il loro orbitale s:
Il rimanente orbitale p "puro" lega l'atomo di ossigeno e la molecola di formaldeide ha la seguente struttura:
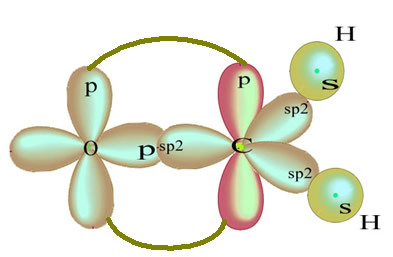
Per quanto riguarda il tipo di legami esistenti in questa struttura di formaldeide, abbiamo:

Connessioni: 1 = 2 = σs-sp2
3 = σp-sp2
4 =πp-p
di Jennifer Fogaça
Laureato in Chimica
Vorresti fare riferimento a questo testo in un lavoro scolastico o accademico? Guarda:
FOGAÇA, Jennifer Rocha Vargas. "Ibridazione di tipo Sp2"; Scuola Brasile. Disponibile in: https://brasilescola.uol.com.br/quimica/hibridizacao-tipo-sp2.htm. Consultato il 28 giugno 2021.