Metalli sono elementi caratterizzati da brillantezza, resistenza, conducibilità termica ed elettrica. Sono applicabile in quasi tutti i processi industriali, essendo presente in leghe metalliche utilizzate nella fabbricazione di utensili, gioielli e monete e in processi chimici come il redox, responsabili del funzionamento di pile e batterie.
Nella tavola periodica sono classificati in:
semimetalli
metalli di transizione
metalli alcalini
metalli alcalino-terrosi
Nell'industria siderurgica, sono suddivisi in:
metalli ferrosi
metalli non ferrosi
metalli pesanti
Leggi anche: Quali sono i nuovi elementi della tavola periodica?
Caratteristiche del metallo

Sono, per la maggior parte, ottimi conduttori di calore ed energia elettrica.
Hanno un aspetto lucido.
avere alto densità.
Sono elementi elettropositivi (tendono a formare cationi - cariche positive).
Ad eccezione di of Mercurio, sono elementi ad alto punto di fusione e solidi a temperatura ambiente.
Hanno resistenza meccanica (tenacia).
Sono malleabili (possono essere modellati senza rompersi).
Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
Metalli della tavola periodica
metalli alcalini
Sono gli elementi di prima colonna della tavola periodica, famiglia 1A. Sono chiamati metalli alcalini perché, mescolati con acqua, formano idrossidi, cioè una soluzione alcalina (basica).
voi elementi che appartengono a questo gruppo sono:
Litio (li)
Sodio (A)
Potassio (K)
Rubidio (Rb)
Cesio (Cs)
Francio (Fra)
La configurazione elettronica dei metalli alcalini allo stato neutro (non caricato/ionizzato) presenta solo un elettrone nell'ultimo guscio (strato di valenza). oh raggio atomico e la reattività di questi metalli aumenta dall'alto verso il basso (osservando la Tavola periodica). Hanno un punto di fusione basso rispetto ad altri metalli, sono malleabili e poco densi, hanno un aspetto opaco dovuto alla alto potenziale di ossidazione.
Vedi anche:Quali sono le proprietà della materia?
metalli alcalino-terrosi
Questi sono elementi che compaiono nel in seconda colonna della tavola periodica, famiglia 2A. sono chiamati terra alcalina dalla tendenza a formare soluzioni di carattere basico (alcalino), e di quelle terrose perché, prima del XIX secolo, gli ossidi formati da queste sostanze erano così designati. Questo termine è stato usato per designare metalli non insolubili che non hanno subito mutazioni quando riscaldati, caratteristiche comuni degli elementi del gruppo 2. Successivamente, alla luce di nuove ricerche ed esperimenti, si scoprì che gli elementi “terrestri” erano in realtà ossidi formati da metalli.
Sono metalli malleabili, a bassa densità, hanno due elettroni nel suo guscio più esterno, si trovano, in condizioni normali di temperatura e pressione, allo stato solido. Appartengono a questo gruppo:
Berillio (Essere)
Magnesio (mg)
Calcio (Qui)
Stronzio (Sig.)
Bario (Ba)
Radio (Rana)
metalli di transizione
compongono il gruppo B della tavola periodica, e si trovano tra i metalli alcalino-terrosi e il ametalli. Sono stati definiti da IUPAC come elementi che hanno un sottostrato energetico energéticad incompleto. Il termine "metalli di transizione" si riferisce a passaggio dal gruppo 2 al 13 nella tavola periodica e l'aggiunta crescente di elettroni nell'orbitale "d".
Il gruppo dei metalli di transizione è composto da elementi densi, con alti punti di fusione e di ebollizione, e meno reattivo dei metalli del gruppo 1 e 2 (Famiglia 1A e 2A). Tra i metalli di transizione vi sono il tungsteno, che è l'elemento con il punto di fusione più alto (3422 °C), e il mercurio (Hg), che è un metallo liquido in condizioni normali di temperatura e pressione, il suo punto di fusione è (-38,83 °C).
I metalli di transizione hanno vari stati di ossidazione (NOX variabile) e formano sostanze colorate.

Elementi di transizione interni
Elementi di transizione interni sono:
Lantanidi: serie composta da elementi che hanno da 57 a 71 protoni e che, ad eccezione del promezio, sono naturali.
attinidi: gruppo formato dagli elementi che vanno da 89 a 103 in numero atomico e che, per la maggior parte, sono sintetici. Tutto questo gruppo è radioattivo con breve emivita.
Gli elementi di questi due gruppi hanno un alto punto di fusione e sono tutti solidi a temperatura ambiente.
Semimetalli
voi semimetalli ci sono, in tutto, sette elementi:
Boro (B)
Silicio (Si)
Germanio (Ge)
Arsenico (come)
Antimonio (lun)
Tellurio (Te)
Polonio (Po)
Questa classificazione è data agli elementi che hanno caratteristiche fisico-chimiche rilevanti per i metalli e anche altre rilevanti per gli elementi non metallici. I semimetalli hanno una lucentezza, sono composti fragili, capaci di formare cationi e anche anioni (a seconda delle condizioni), e sono conduttori intermedi.
Tipi di metalli
ferroso: sostanze che contengono ferro nella loro composizione. Sono leghe metalliche che contengono ferro come elemento comune, ma possono essere formulati con diverse concentrazioni di carbonio, ad esempio, o forgiati con tecniche diverse, avendo così prodotti con proprietà fisiche diverse.
Non ferrosi: leghe formate da altri tipi di metalli, come alluminio, rame, nichel, zinco, titanio.
Metalli pesanti: piombo, nichel, zinco, mercurio. Sono metalli reattivi, tossici e bioaccumulabili. Sono utilizzati in batterie, lampade, munizioni per manufatti bellici, tra gli altri.
Legami chimici dei metalli
I metalli sono elementi elettropositivo, cioè hanno la tendenza a perdere elettroni in un legame chimico. Quando un metallo interagisce con un non metallo, eseguire un legame ionico a causa della differenza di elettronegatività. L'altra possibilità di legame per i metalli sono i legami metallici.
A connessioni metalliche avvengono tra metalli, con rilascio parziale di elettroni e formazione di una nuvola o mare di elettroni attorno agli atomi, che garantisce alle parti metalliche le proprietà di conducibilità elettrico e malleabilità.
Vedi anche: Conduttori e isolanti: quali sono le differenze?
Ottenere metalli
La maggior parte dei metalli si trova naturalmente in rocce e minerali associati ad altri elementi. Esistono diverse tecniche per raffinare i metalli, come l'elettrolisi e le reazioni chimiche per separare i composti.
Nel caso dei metalli, le due tecniche più utilizzate su scala industriale per ottenere un certo grado di purezza in un metallo sono: differenza di densità e suscettibilità magnetica (tendenza che il metallo deve reagire ad a campo magnetico).

esercizi risolti
Domanda 1 - (Enem) Il cadmio, presente nelle batterie, può raggiungere il suolo quando questi materiali vengono dispersi irregolarmente nell'ambiente o quando vengono inceneriti. A differenza della forma metallica, gli ioni Cd2+ sono estremamente pericolosi per l'organismo in quanto possono sostituire Ioni Ca2+, che causano una malattia degenerativa delle ossa, rendendole molto porose e causando forti dolori alle ossa. giunti. Possono anche inibire gli enzimi attivati dal catione Zn2+, che sono estremamente importanti per il funzionamento dei reni. La figura mostra la variazione del raggio di alcuni metalli e dei rispettivi cationi.
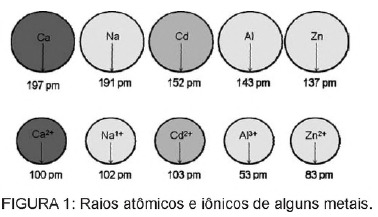
In base al testo, la tossicità del cadmio nella sua forma ionica è una conseguenza di questo elemento
A) presentano una bassa energia di ionizzazione, che favorisce la formazione dello ione e ne facilita il legame con altri composti.
B) hanno la tendenza ad agire in processi biologici mediati da cationi metallici con cariche comprese tra +1 e +3.
C) hanno raggio e carica relativamente vicini agli ioni metallici che agiscono sui processi biologici, provocando interferenze in questi processi.
D) hanno un ampio raggio ionico, che gli consente di interferire nei processi biologici in cui normalmente partecipano ioni più piccoli.
E) hanno una carica +2, che gli permette di interferire con i processi biologici a cui, normalmente, partecipano ioni con carica inferiore.
Risoluzione
Alternativa C. Il cadmio è un elemento simile agli ioni metallici che abbiamo naturalmente nel corpo. Oltre ad essere bioaccumulabile, il cadmio, avendo questa somiglianza con i gruppi metallici, può legarsi a gruppi sulfidrilici di molecole di proteine, causando così cambiamenti nei processi biologici, come la decalcificazione e la distruzione dei tessuti e dei globuli rossi sangue.
Domanda 2 - Per le caratteristiche relative ai metalli, selezionare l'alternativa errata.
A) La maggior parte dei metalli sono buoni conduttori elettrici e termici.
B) Alcuni metalli sono suscettibili di ossidazione e/o riduzione.
C) Il ferro è un metallo resistente e malleabile, cioè facile da modellare.
D) I metalli alcalino terrosi hanno questo nome “terra” riferendosi agli ossidi di questi metalli, che sono di colore scuro.
E) I metalli sono elementi di vario colore e opachi, per l'azione dell'ossidazione.
Risoluzione
Alternativa E. I metalli sono naturalmente lucidi e di colore metallico, possono subire ossidazioni, che provocano alterazioni delle caratteristiche rilevanti per la aspetto del pezzo, ma questo non è un fenomeno che accade in tutti i metalli e, in alcuni casi, l'ossidazione dipende da diversi fattori esterno.
di Laysa Bernardes
Insegnante di chimica



