Batteria è un dispositivo in cui viene prodotta una corrente elettrica da energia chimica proveniente da a reazione di ossidoriduzione, cioè una specie del reagente perde elettroni (ossidazione), mentre un'altra specie acquista elettroni (riduzione).
Vedere le rappresentazioni delle reazioni di ossidazione e riduzione che si verificano in qualsiasi stack:
Ossidazione: X → e + X+
La specie X perde un elettrone e si trasforma in un catione.
Riduzione: sì- + e → Y
l'anione Y- acquista elettroni e si trasforma in una specie Y neutra.
Componenti di base di uno stack
I componenti di base di uno stack sono:
Anodo: elettrodo negativo in cui avviene la reazione di ossidazione, cioè perdita di elettroni;
Catodo: elettrodo positivo in cui avviene la reazione di riduzione, cioè guadagno di elettroni;
Una soluzione elettrolitica (ponte salino) o un materiale conduttivo (come una barra di grafite): è il mezzo attraverso il quale gli elettroni ceduti dall'anodo raggiungono il catodo.
Nozioni di base su come funziona una batteria
Il funzionamento di uno stack avviene dai seguenti eventi:
1° Principio: Ossidazione anodica
Il metallo nell'anodo, poiché ha una maggiore tendenza a perdere elettroni, diventa un catione, come possiamo vedere nell'equazione seguente:
Zn → Zn2+ + 2 e
2° Principio: riduzione del catodo
I cationi che fanno parte del materiale presente nel catodo (useremo il rame come esempio), al momento della ricezione gli elettroni dell'anodo si trasformano in rame metallico, come si vede nell'equazione sotto:
Culo2+ + 2e → Cu
prime pile
a) La batteria di Alessandro Volta
La schiena di Alessandro (la prima pila della storia), assemblata nel 1800, era formata da dischi metallici intercalati, come nell'immagine sottostante:

Assemblaggio simile a Torna alla tua pila di Alessandro
I dischi erano intercalati perché avevano una composizione diversa. Uno era fatto di metallo di zinco e l'altro era di rame, sempre separati da cotone imbevuto di salamoia (una soluzione formata da acqua e sale).
B) Il mucchio di Daniell
La pila di Daniell, assemblata nel 1836, consisteva di due semicelle collegate da un filo conduttore e da un ponte salino.
Semicella 1: era l'anodo, cioè il polo negativo della batteria.
Era composto da una lastra di zinco, e una parte di questa lastra fu immersa in una soluzione formata da acqua e solfato di zinco (ZnSO4).
Mezza cella 2: era il catodo, cioè il polo positivo della batteria.
Era composto da una lastra di rame, e una parte di questa lastra fu immersa in una soluzione formata da acqua e solfato di rame (CuSO4).
ponte di sale
Tubo a forma di U che conteneva una soluzione formata da acqua e cloruro di potassio (KCl), che collegava le due semicelle (zinco e rame) e aveva una lana di vetro alle due estremità.
batterie attualmente
Attualmente esistono diversi modelli di pali, ma, in generale, seguono il seguente aspetto:
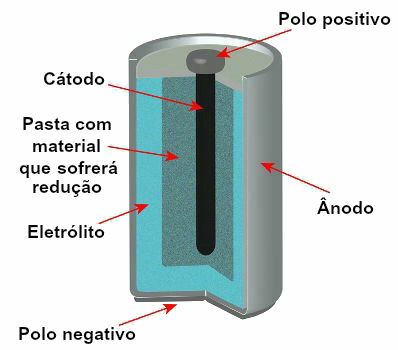
Schema che rappresenta il modello di uno stack corrente
I modelli più utilizzati sono la cosiddetta batteria Leclanché e la batteria alcalina, che presentano le seguenti differenze:
Il) Mucchio Leclanche
Ha un anodo formato da zinco metallico;
Ha un catodo formato da una pasta con cloruro di ammonio, acqua, amido e biossido di manganese;
Ha una barra di grafite che funge da conduttore per gli elettroni che partono dal catodo verso l'anodo.
B) Batteria alcalina
Ha un anodo formato da zinco metallico o cadmio;
Ha un catodo formato da ossido di mercurio, ossido di nichel e iodio;
Deve avere una base mista nel materiale che compone il catodo.
Di Me. Diogo Lopes Dias
Fonte: Scuola Brasile - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-pilha.htm
