Il fenomeno della radioattività attirò l'attenzione di numerosi scienziati, tra cui il fisico neozelandese Ernest Rutherford (1871-1937). Eseguì un esperimento in cui un raggio di particelle alfa (α) è stato sottoposto a un campo elettrico. Rutherford notò alla fine dell'esperimento che questa radiazione sarebbe formata da particelle positive, poiché è stata attratta dal polo negativo.
Ha anche scoperto che c'erano particelle negative che erano attratte dal polo positivo; queste erano le particelle beta (β).Inoltre, questa radiazione aveva un potere di penetrazione maggiore della radiazione alfa.
Tuttavia, c'era una delle emissioni radioattive, il gamma (γ), che non era attratto da nessuno dei poli. Questo è ancora più energetico di altre radiazioni. Pertanto, si è concluso che la radiazione gamma (γ) non è costituita da particelle, ma, come i raggi X, sarebbe formata da onde elettromagnetiche, oltre a non avere né carica né massa. Poiché non ha carica, questa radiazione non subisce interferenze nel campo elettrico.
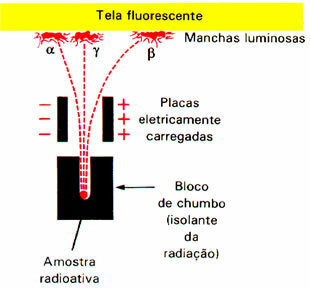
Un esperimento condotto da Rutherford ha rilevato che le particelle alfa e beta sono state deviate dal campo elettromagnetico.
Questo ed altri studi successivi dimostrarono che il modello atomico di Dalton, in cui l'atomo sarebbe una sfera, massiccia e indivisibile, non poteva essere corretto; poiché, come si è visto sopra, l'atomo dovrebbe avere particelle più piccole con cariche positive e negative.
Nel 1911, Rutherford propose che l'atomo fosse composto da un nucleo atomico, in cui sarebbero le particelle positive, chiamate protoni; e nell'elettrosfera, cioè nella regione intorno al nucleo, le particelle negative (elettroni) ruoterebbero su orbite circolari.
Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
Egli stesso in seguito scoprì che la radioattività era un fenomeno che si verificava nei nuclei atomici instabili.
Fisici F. Soddy, A. Russel e K. I Fajan, indipendentemente l'uno dall'altro, scoprirono quali erano le parti corrispondenti di queste radiazioni all'interno dell'atomo:
*Particelle alfa (α):Quando emette una particella alfa, l'atomo dell'elemento radioattivo emette in realtà due protoni e due neutroni (la carica positiva è dovuta ai protoni);

Quando un elemento emette una particella alfa emette due protoni e due neutroni.
*Particelle beta (β): Quando un elemento radioattivo emette una particella beta, perde un elettrone e una sottoparticella chiamata antineutrino. Un neutrone si decompone, dando origine a un protone che rimane nel nucleo, un elettrone e un antineutrino che vengono emessi.
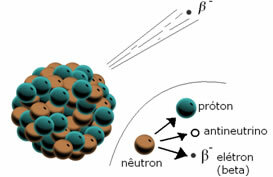
Quando un elemento emette una particella beta, emette un elettrone.
Pertanto, la caratterizzazione di questi tre tipi di radiazioni è riportata di seguito:
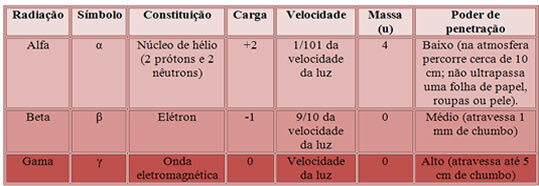
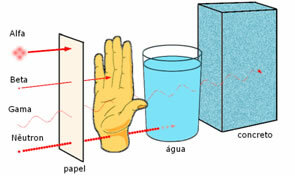
Potere di penetrazione delle tre principali radiazioni nucleari.
di Jennifer Fogaça
Laureato in Chimica
Squadra scolastica brasiliana.
Vorresti fare riferimento a questo testo in un lavoro scolastico o accademico? Guarda:
FOGAÇA, Jennifer Rocha Vargas. "Radioattività e struttura dell'atomo"; Scuola Brasile. Disponibile in: https://brasilescola.uol.com.br/quimica/radioatividade-estrutura-atomo.htm. Consultato il 27 giugno 2021.
