Come mostrato nei testi"Spettro elettromagnetico degli elementi chimici" e "Spettri di emissione e assorbimento e leggi di Kirchhoff”, gli spettri di emissione discontinua di ciascun elemento chimico sono diversi.

Quindi, di seguito abbiamo gli spettri distinti di alcuni di questi elementi:

Così, il fisico danese Niels Böhr (1885-1962) si rese conto che ciò poteva essere correlato alla struttura dell'atomo di ciascuno di questi elementi. Quindi propose un modello atomico che completava il modello di Rutherford, ma si concentrava sul comportamento degli elettroni circostanti nel nucleo dell'atomo.
Tempo prima Max Planck (1858-1947) aveva proposto una teoria secondo cui gli elettroni sono quantizzato, nel senso che sono emettono e assorbono determinate quantità di energia, come se fossero piccoli pacchetti di energia, che chiamò quanto (quantistica, al singolare).
Pertanto, Böhr ha proposto quanto segue: poiché ogni elemento ha uno spettro diverso, ogni elemento ha nel suo atomo elettroni di energie costanti e diverse da elemento a elemento.
Ogni elettrone può stare solo in una certa orbita specifica, perché in ognuna di queste orbite l'elettrone ha un'energia costante, ben definita e caratteristica. L'elettrone può occupare solo i livelli energetici per i quali possiede la rispettiva energia.
Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
Gli spettri sono discontinui perché gli elettroni sono quantizzati.
Un elettrone può cambiare livello solo se assorbe energia. Ad esempio, quando si brucia un sale di sodio in un becco Bunsen, si fornisce energia agli elettroni. Quando assorbe un quanto di energia, l'elettrone salta a un altro livello più energetico, rimanendo nello stato eccitato. Tuttavia, lo stato fondamentale è più stabile, quindi questo elettrone emette l'energia assorbita e ritorna alla sua orbita originale. Emette questa energia sotto forma di onde elettromagnetiche che possono essere visualizzate sotto forma di luce. Nel caso del sodio, questa luce è di colore giallo intenso. Quindi, quando queste onde passano attraverso un prisma, si ottiene lo spettro discontinuo del sodio.
Quindi, per Böhr, ogni riga luminosa che appariva nello spettro discontinuo degli elementi indicava l'energia rilasciata quando l'elettrone ritornava da un livello esterno a uno più vicino al nucleo.
La figura seguente aiuta a comprendere meglio questo problema:
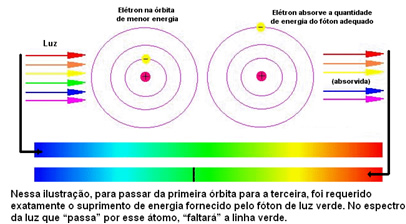
Poiché agli atomi di ciascun elemento sono consentiti solo determinati valori energetici che corrispondono agli strati energetici, per ogni elemento esiste uno spettro diverso.
di Jennifer Fogaça
Laureato in Chimica
Vorresti fare riferimento a questo testo in un lavoro scolastico o accademico? Guarda:
FOGAÇA, Jennifer Rocha Vargas. "Spettri elettromagnetici e struttura dell'atomo"; Brasile Scuola. Disponibile in: https://brasilescola.uol.com.br/quimica/espectros-eletromagneticos-estrutura-atomo.htm. Consultato il 27 giugno 2021.