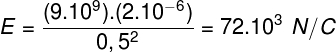IL PrimoLeggedàTermodinamica è un'applicazione di principiodàconservazionedàenergia per sistemi termodinamici. Secondo questa legge, la variazione di Energia interna di un sistema termodinamico è la differenza tra la quantità di calore assorbito dal sistema e dal lavoro da esso svolto.
Guardaanche:Concetti fondamentali e sintesi della Termologia
Qual è la prima legge della termodinamica?
La Prima Legge della Termodinamica è una diretta conseguenza del principio di conservazione dell'energia. Secondo questo principio, l'energia totale di un sistemarimane sempre costante, poiché non è perduta, ma trasformata.
Nell'ambito di Termodinamica, sono usati nozioni più specifiche e meno generici di quelli utilizzati nel principio del risparmio energetico. Nella prima legge della termodinamica, usiamo concetti come energiainterno,calore e lavoro, che sono pertinenti all'ambito di applicazione di Macchine termiche (applicazioni tecnologiche di fondamentale importanza per la Termodinamica).

Immaginate una macchina a vapore, quando il fluido di lavoro di quella macchina (vapore acqueo) riceve calore da una fonte esterna, sono possibili due conversioni di energia: il vapore può avere la sua temperatura aumentata di qualche grado o, addirittura, può espandere e muovere i pistoni di quella macchina, eseguendo così una certa quantità di lavoro.
"La variazione dell'energia interna di un sistema termodinamico corrisponde alla differenza tra la quantità di calore assorbita da esso e la quantità di lavoro che questo sistema svolge".
Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
Formula della prima legge della termodinamica
La formula utilizzata per descrivere matematicamente la Prima Legge della Termodinamica è mostrata di seguito:

tu – variazione di energia interna (cal o J)
Q – calore (calce o J)
τ – lavoro (lime o J)
Per utilizzare questa formula, dobbiamo prestare attenzione ad alcune regole di segnale:
U – sarà positivo se la temperatura dell'impianto aumenta;
U – sarà negativo se la temperatura dell'impianto diminuisce;
Q – sarà positivo se il sistema assorbe calore dall'ambiente esterno;
Q – sarà negativo, se l'impianto cede calore all'ambiente esterno;
τ – sarà positivo se il sistema si espande, eseguendo lavori sull'ambiente esterno;
τ – sarà negativo se il sistema si contrae, ricevendo lavoro dall'ambiente esterno.
variazione di energia interna
Il termine ΔU si riferisce alla variazione di energia attribuita al energia cinetica delle particelle costituenti il sistema, nel caso di un gas ideale, si può dire che ΔU è equivalente a:

no – numero di moli (mol)
R – costante universale dei gas ideali (0,082 atm.l/mol. K o 8,31 J/mol. K)
T – temperatura assoluta (kelvin)
Analizzando le formule si vede che, se non c'è variazione di temperatura nel sistema, la sua Energia interna rimarranno anche invariati. Inoltre è importante dire che per le macchine termiche, che operano in cicli, la variazione dell'energia interna, alla fine di ogni ciclo, deve essere nulla, perché a quel punto il motore torna a funzionare con la temperatura iniziale.
Guardaanche:Prestazioni delle macchine termiche: come si calcolano?
Calore
Passando al termine successivo, Q, che si riferisce alla quantità di calore trasferita al sistema, usiamo solitamente il equazione fondamentale della calorimetria, mostrato di seguito:

Q -calore (calce o J)
m – massa (g o kg)
ç – calore specifico (cal/gºC o J/kg. K)
T – variazione di temperatura (celsius o kelvin)
Lavoro
L'ultima delle grandezze relative alla Prima Legge della Termodinamica è il lavoro (τ), che ha a formula analitica solo per trasformazioni che avvengono sotto pressione costante, nota anche piace trasformazioni isobariche, orologio:

P – pressione (Pa o atm)
V – variazione di volume (m³ o l)
Quando la pressione esercitata sul sistema non è costante, il lavoro può essere calcolato dall'area del grafico della pressione in funzione del volume (P x V). Per saperne di più su questa grandezza scalare, visita: lavoro.
esercizi risolti
Domanda 1)(CefetMG) Il lavoro svolto in un ciclo termico chiuso è pari a 100 J, ed il calore coinvolto negli scambi termici è pari rispettivamente a 1000 J e 900 J, con sorgente calda e fredda.
Dalla prima legge della termodinamica, la variazione dell'energia interna in questo ciclo termico, in joule, è
a) 0
b) 100
c) 800
d) 900
e) 1000
Risoluzione
Alternativa a.
Risolviamo l'esercizio usando la Prima Legge della Termodinamica, nota:

Secondo l'affermazione, ci viene chiesto di calcolare la variazione di energia interna in un ciclo termodinamico chiuso, nel qual caso sappiamo che il la variazione di energia interna deve essere nulla, in quanto la macchina tornerà a funzionare alla stessa temperatura di inizio ciclo.
Domanda 2)(Upf) Un campione di un gas ideale si espande raddoppiando il suo volume durante una trasformazione isobarica e adiabatica. Considerando che la pressione sperimentata dal gas è 5.106 Pa e il suo volume iniziale 2.10-5 m³, possiamo dire:
a) Il calore assorbito dal gas durante il processo è di 25 cal.
b) Il lavoro compiuto dal gas durante la sua espansione è di 100 cal.
c) La variazione di energia interna del gas è –100 J.
d) La temperatura del gas rimane costante.
e) Nessuna delle precedenti.
Risoluzione
Alternativa c.
Utilizzando le informazioni fornite dalla dichiarazione dell'esercizio, utilizzeremo la prima legge della termodinamica per trovare l'alternativa corretta:

Domanda 3)(Wow) Una bomboletta da cucina contiene gas ad alta pressione. Quando apriamo questo cilindro, notiamo che il gas fuoriesce rapidamente nell'atmosfera. Poiché questo processo è molto veloce, possiamo considerarlo un processo adiabatico.
Considerando che il Primo Principio della Termodinamica è dato da ΔU = Q - W, dove ΔU è la variazione di energia all'interno del gas, Q è l'energia trasferita sotto forma di calore e W è il lavoro svolto dal gas, questo è corretto affermare che:
a) La pressione del gas è aumentata e la temperatura è diminuita.
b) Il lavoro svolto dal gas è stato positivo e la temperatura del gas non è cambiata.
c) Il lavoro svolto dal gas è stato positivo e la temperatura del gas è diminuita.
d) La pressione del gas è aumentata e il lavoro svolto è stato negativo.
Risoluzione
Alternativa c.
Una volta che il volume del gas si espande, diciamo che il lavoro svolto è stato positivo, cioè il gas stesso ha svolto un lavoro sull'ambiente esterno. Inoltre, poiché il processo avviene molto rapidamente, non c'è tempo per il gas di scambiare calore con l'ambiente circostante, quindi si verifica quanto segue:

Secondo il calcolo, l'energia interna del gas diminuisce di una quantità pari al lavoro svolto. dal gas, inoltre, poiché si ha una diminuzione dell'energia interna del gas, si ha anche una diminuzione di temperatura.
Domanda 4)(Udesc) In un laboratorio di fisica si fanno esperimenti con un gas che, ai fini dell'analisi termodinamica, può essere considerato un gas ideale. Dall'analisi di uno degli esperimenti, in cui il gas è stato sottoposto a un processo termodinamico, si è concluso che tutto il calore fornito al gas è stato convertito in lavoro.
Controlla l'alternativa che rappresenta correttamente il processo termodinamico eseguito nell'esperimento.
a) processo isovolumetrico
b) processo isotermico
c) processo isobarico
d) processo adiabatico
e) processo composito: isobarico e isovolumetrico
Risoluzione
Alternativa B.
Affinché tutto il calore fornito a un gas possa essere convertito in lavoro, non deve esserci assorbimento di energia interna da parte di esso, in altre parole, il gas ha bisogno di passare attraverso un processo isotermico, cioè un processo che avviene a temperatura costante.
Di Rafael Hellerbrock
Insegnante di fisica