Quando sottoponiamo diversi elementi all'azione di una fiamma, notiamo che ognuno emette un colore diverso. Ad esempio, se bruciamo un sale di stronzio, di sodio e di rame, vedremo, rispettivamente, i colori rosso, giallo intenso e verde, come mostrato nella figura seguente:

Se la luce di queste fiamme cade su un prisma, a spettro discontinuo, cioè, si osserveranno solo poche linee luminose colorate intervallate da regioni senza luce. Per ogni elemento avremo uno spettro diverso.

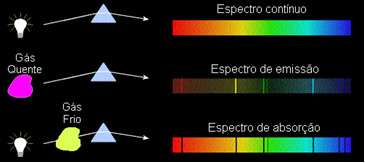
Questi tipi di spettri sono chiamati spettro di emissione, in quanto emessi da un determinato elemento e servono ad identificarlo.
È possibile ottenere spettri come questo per mezzo di un fascio di luce prodotto in un tubo a scarica elettrica ad alta temperature e basse pressioni, contenenti gas di determinati elementi come l'idrogeno o come gas nobili noble sotto:

Facendo passare questa radiazione elettromagnetica (luce) prodotta attraverso un prisma, si ottengono gli spettri di emissione di ciascuno di questi elementi.
In precedenza si pensava che lo spettro solare ottenuto fosse totalmente continuo, ma lo scienziato inglese William Hyde Wollaston scoprì che da lavorando con un fascio di luce molto stretto, con una fenditura di circa 0,01 mm, si vedeva che lo spettro solare conteneva sette righe nere a proposito. Più tardi, il giovane Joseph Fraunhofer (1787-1826), usando prismi e reticoli di diffrazione, scoprì che lo spettro solare contiene in realtà migliaia di linee nere sovrapposte.
Qualche tempo dopo il fisico Gustav Robert Kirchhoff notò che le macchie gialle, ottenute dallo spettro del sodio, erano esattamente nello stesso posto di due linee nere nello spettro del Sole. lui e il chimico Robert Wilhelm Bunsen eseguì diversi esperimenti e notò che se una luce bianca del becco Bunsen, come la luce solare, passava dalla luce gialla emessa dal sodio e il prisma veniva attraversato per generare lo spettro; il risultato sarebbe uno spettro solare continuo, nei colori dell'arcobaleno, ma con le linee nere (chiamate linee D da Fraunhofer) nella stessa posizione delle linee gialle nello spettro del sodio.
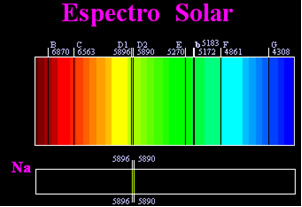
Il Sole emette luce di tutti i colori, dal rosso al viola, tuttavia, quando attraversano l'atmosfera terrestre, i gas presenti assorbono la luce del Sole esattamente nei colori che emettono.
Questi tipi di spettri sono chiamati spettri di assorbimento.
Sulla base di queste osservazioni, Kirchoff creato tre legislazione per spettroscopia, che sono:
1) Un corpo opaco caldo, in uno qualsiasi dei tre stati fisici, emette uno spettro continuo.
2) Un gas trasparente – come quelli dei gas nobili che abbiamo visto sopra – produce a spettro di emissione, con la comparsa di Linee luminoso. Il numero e la posizione di queste linee saranno determinati dagli elementi chimici presenti nel gas.
3) Se a spettro continuo passa attraverso un gas alla temperatura più bassa, il gas freddo provoca la presenza di linee scure, cioè un spettro di assorbimento. Questo è quello che è successo allo spettro della luce solare che passa attraverso il gas sodio. In questo caso il numero e la posizione delle righe nello spettro di assorbimento dipendono anche dagli elementi chimici presenti nel gas.
di Jennifer Fogaça
Laureato in Chimica
Fonte: Scuola Brasile - https://brasilescola.uol.com.br/quimica/espectros-emissao-absorcao-leis-kirchhoff.htm

