Elektrolisis air terdiri dari penguraian zat ini melalui arus listrik dan penambahan elektrolit. Mari kita lebih memahami bagaimana ini terjadi?
Baca juga: Apa itu elektrolisis?
Bagaimana elektrolisis air terjadi?
Molekul air mampu melakukan ionisasi sendiri, menghasilkan ion H+ (atau H3HAI+) dan oh-:
H2O H+ + OH-
atau
2 jam2O H3HAI+ + OH-
Namun, air adalah elektrolit yang sangat lemah dan meskipun memiliki ion-ion ini, ia tidak dapat menghantarkan arus listrik. Jadi, untuk melakukan elektrolisisnya, yaitu penguraiannya melalui arus listrik, perlu ditambahkan elektrolit, zat terlarut ionik yang dapat berupa garam, basa, atau asam.

Urutan prioritas untuk pelepasan selektif
Namun, seperti yang dijelaskan dalam teks Elektrolisis berair, dalam hal ini, kita tidak hanya akan memiliki ion yang berasal dari air, tetapi juga zat yang terlarut di dalamnya. Dalam elektrolisis, hanya satu kation dan satu anion yang dilepaskan di elektroda, yaitu a pelepasan selektif mengikuti urutan prioritas.
Dengan demikian, agar katoda dan anoda yang akan dibuang adalah air, bukan zat terlarut, perlu dipilih AC id, basa atau garam yang ion-ionnya lebih mudah dilepaskan dari elektroda dibandingkan ion-ion dalam air. Untuk melakukan ini, kita perlu berkonsultasi dengan antrian prioritas yang ditunjukkan di bawah ini:
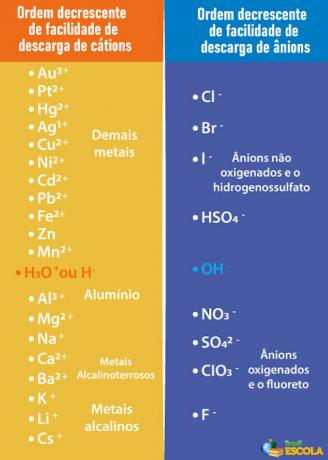
Perhatikan bahwa kation yang tercantum di bawah H+ memiliki lebih sedikit kemudahan pembongkaran daripada itu. Pada tabel di sebelah kanan, kita melihat bahwa anion di bawah OH- memiliki lebih sedikit kemudahan pembongkaran. Oleh karena itu, kita dapat memilih, misalnya, garam, basa, atau asam yang membentuk ion Na.+, K+, PADA3-, HANYA42- dan seterusnya, selain juga membentuk ion yang sama dengan air, yaitu H+ dan oh-. Beberapa contohnya adalah: asam sulfat (H2HANYA4), natrium hidroksida (NaOH) dan kalium nitrat (KNO)3).
Jangan berhenti sekarang... Ada lagi setelah iklan ;)
Contoh dengan reaksi yang terjadi pada elektrolisis air
Katakanlah elektrolisis air dilakukan dengan penambahan asam sulfat. Dalam hal ini, kita akan memiliki pembentukan ion berikut di tengah:
Disosiasi asam: 1 H2HANYA4 → 2 H+ + 1 SO42-
Autoionisasi air: H2O → H+ + OH- atau 2 jam2O → H3HAI+ + OH-
Perhatikan bahwa satu-satunya kation yang ada adalah H.+, jadi dialah yang akan mengalami pengurangan (keuntungan .) elektron) pada elektroda negatif (katoda) dan akan menghasilkan gas hidrogenHAI (H2).
Sekarang, berbicara tentang anion, ada dua anion di tengah, yaitu OS42- dan oh-. Seperti yang ditunjukkan tabel di atas, OS42- itu lebih reaktif dan kurang mudah untuk dibuang. Jadi, OH- akan dibuang, mengoksidasi (kehilangan elektron) di elektroda positif (anoda) dan akan menghasilkan gas oksigen(HAI2):
Setengah reaksi katoda: 4 H3HAI+ + 4 dan- → H2O+H2
Setengah reaksi anoda: 4 OH- → 2 H2O + 1 O2 + 4 dan-
Menambahkan seluruh proses ini, kita sampai pada persamaan global:
Ionisasi air: 8 H2O → 4 H3HAI+ + 4 OH-
Setengah reaksi katoda: 4 H3HAI+ + 4 dan- → 4 H2O + 2 H2
Setengah reaksi anoda: 4 OH- → 2 H2O + 1 O2 + 4 dan-
Persamaan global: 2H2O → 2 H2 + 1 O2
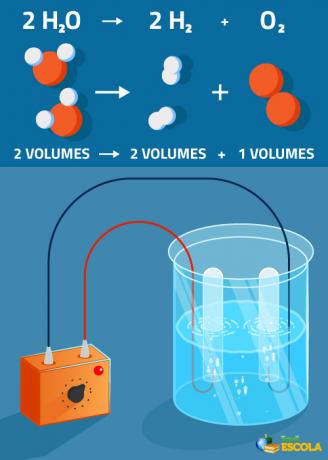
Perhatikan bahwa volume hidrogen yang dihasilkan adalah dua kali lipat dari oksigen. Namun, dalam praktiknya, rasio ketat ini tidak diverifikasi karena oksigen lebih larut daripada gas hidrogen.
Baca juga: Mendapatkan aluminium melalui elektrolisis
Aplikasi elektrolisis air
Elektrolisis air merupakan proses yang sangat penting, mengingat hidrogen merupakan gas yang dapat digunakan sebagai bahan bakar. Seperti bahan bakar turunan minyak bumi tidak terbarukan, gas hidrogen bisa menjadi alternatif penting.
Selain itu, sudah ada metode produksi bensin yang menggunakan proses elektrolisis air. Lihat bagaimana ini dilakukan dalam teks Ilmuwan mampu mengubah karbon dioksida menjadi bensin.
Oleh Jennifer Fogaa
guru kimia
Apakah Anda ingin mereferensikan teks ini di sekolah atau karya akademis? Lihat:
FOGAÇA, Jennifer Rocha Vargas. "Elektrolisis air"; Sekolah Brasil. Tersedia di: https://brasilescola.uol.com.br/quimica/eletrolise-agua.htm. Diakses pada 28 Juni 2021.
Kimia

Aplikasi Elektrolisis, elektroplating, pelapisan nikel, pelapisan krom, nikel, kromium, katoda, natrium, aluminium, klorin, soda kaustik, gas hidrogen, elektrolisis beku, elektrolisis air, logam alkali, alkali tanah, gas klorin.
Kimia

Elektrolisis, larutan elektrolit, arus listrik, reaksi oksidasi-reduksi, proses kimia spontan, proses kimia tidak spontan, transformator, transformasi buatan, industri, logam alkali, alkali tanah, gas hidrogen, gas hydrogen cl



