Di antara kompleksitas studi atom adalah menentukan ukuran atom atau, lebih baik, sinar atom. Sifat periodik ini menggambarkan jarak dari nukleus ke elektron terluar dari tingkat elektroniknya. Untuk menentukannya, rata-rata aritmatika jarak antara inti dua atom yang membentuk zat sederhana, misalnya, dilakukan.

Representasi jarak antara dua inti atom
Mari kita tentukan jari-jari atom (RA) atom yang ditunjukkan pada gambar. Untuk melakukan ini, cukup bagi jarak antara inti dengan 2:
RA = d
2
HAI studi sinar atom penting karena mendukung pemahaman beberapa peristiwa fisik (kepadatan, titik fusi, titik didih dan energi ionisasi) dan bahan kimia (ikatan kimia) yang terjadi dengan atom.
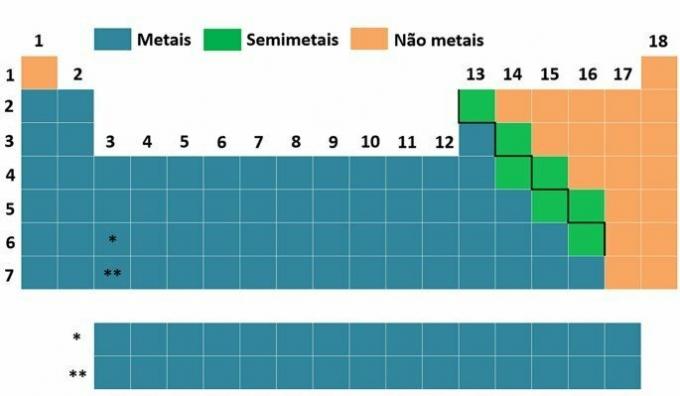
Dengan menganalisis tabel periodik, kita dapat menilai apakah suatu atom lebih besar atau lebih kecil dalam hubungannya dengan yang lain, dan dengan demikian menentukan apakah ia memiliki kemudahan yang lebih besar atau lebih kecil dalam melepaskan satu atau lebih elektron dari orbitalnya. ITU evaluasi dan penentuan jari-jari atom dalam tabel periodik dilakukan menurut dua kriteria dasar:
a) Jumlah tingkat energi (keluarga atau kelompok/kolom vertikal)
Kita tahu bahwa atom dapat memiliki hingga tujuh tingkat energi (K, L, M, N, O, P, Q) dan masing-masing unsur kimia terletak dalam keluarga atau kelompok (kolom vertikal) dan dalam periode (kolom horisontal). Periode menunjukkan jumlah tingkat yang dimiliki atom unsur, dan keluarga menunjukkan subtingkat atom yang paling energik. Dalam kelompok atau keluarga, unsur-unsur kimia berbeda dengan jumlah tingkat energi. Lihat tabel di bawah ini:

Semakin besar jumlah tingkat energi suatu atom, semakin besar jari-jari atomnya. Menganalisis tabel di atas, dapat dilihat bahwa fransium memiliki atom terbesar karena memiliki tujuh tingkatan. Atom kalium, di sisi lain, memiliki jari-jari yang lebih kecil karena memiliki empat tingkat energi. Berikut ini adalah representasi perbandingan antara atom fransium dan atom kalium:

Representasi dari tujuh tingkat energi atom Fransium
Jangan berhenti sekarang... Ada lagi setelah iklan ;)

Representasi dari empat tingkat energi atom Kalium
Diagram berikut menunjukkan bagaimana peningkatan jari-jari atom terjadi dalam keluarga atau golongan yang sama (kolom vertikal) dari tabel periodik. Semakin besar jumlah level, semakin besar radiusnya, yaitu, pada tabel periodik, jari-jari atom tumbuh dari atas ke bawah:

Representasi bagaimana jari-jari atom meningkat dalam keluarga tabel periodik
b) Nomor atom (Z atau jumlah proton) pada periode yang sama (kolom horizontal)
Ketika unsur-unsur kimia termasuk dalam periode yang sama, atom-atomnya memiliki jumlah tingkat energi yang sama, tetapi jumlah proton di dalam nukleusnya berbeda. Berikut ini adalah urutan unsur-unsur yang termasuk dalam periode keempat dari tabel periodik:

Semua atom dari unsur-unsur yang diwakili dalam tabel di atas memiliki empat tingkat energi, tetapi masing-masing memiliki jumlah proton yang berbeda dalam intinya. Karena proton di dalam nukleus mengerahkan gaya tarik menarik pada elektron yang ada di tingkat energi, semakin besar jumlah proton dalam inti, semakin besar daya tariknya terhadap elektron. Hasilnya adalah perkiraan tingkat menuju inti, mengurangi ukuran atom.
↑Z = Jari-jari atom
↓Z = Jari-jari atom
Dengan demikian, kita dapat menyatakan bahwa jari-jari atom unsur kalium lebih besar daripada vanadium karena jumlah proton yang lebih kecil.
Diagram berikut menunjukkan bagaimana jari-jari atom meningkat dalam periode yang sama (garis horizontal). Semakin kecil nomor atom, semakin besar jari-jarinya, yaitu jari-jari atom dalam tabel tumbuh dari kanan ke kiri

Representasi bagaimana jari-jari atom meningkat dalam periode tabel periodik
Oleh Saya Diogo Lopes Dia
Apakah Anda ingin mereferensikan teks ini di sekolah atau karya akademis? Lihat:
HARI, Diogo Lopes. "jari-jari atom"; Sekolah Brasil. Tersedia di: https://brasilescola.uol.com.br/quimica/raio-atomico.htm. Diakses pada 28 Juni 2021.