Setiap sel adalah perangkat di mana reaksi oksidasi-reduksi spontan terjadi yang menghasilkan arus listrik, yang, pada gilirannya, digunakan untuk membuat beberapa peralatan bekerja.
Perangkat ini mendapatkan namanya karena baterai pertama yang dibuat diciptakan oleh Alessandro Kembali pada tahun 1800, itu dibentuk oleh cakram seng dan tembaga yang dipisahkan oleh kapas yang direndam dalam air asin. Set ini ditempatkan diselingi, satu di atas yang lain, menumpuk cakram dan membentuk kolom besar. Bagaimana kabarmu? baterai cakram, mulai dipanggil dengan nama itu.

Baterai selalu terdiri dari dua elektroda dan elektrolit. Elektroda positif disebut katoda dan disinilah reaksi dari pengurangan. Elektroda negatif adalah anoda dan disinilah reaksi dari oksidasi. Elektrolit disebut juga jembatan garam dan merupakan larutan penghantar ion.
Agar Anda memahami bagaimana ini menghasilkan arus listrik, lihat kasus salah satu baterai pertama, tumpukan Daniell, yang didalamnya terdapat wadah berisi larutan tembaga sulfat (CuSO
4 (aq)) dan, dicelupkan ke dalam larutan itu, adalah pelat tembaga. Di wadah lain yang terpisah, terdapat larutan seng sulfat (ZnSO4 (aq)) dan pelat seng yang dicelupkan. Kedua larutan tersebut dihubungkan oleh jembatan garam, yaitu tabung gelas dengan larutan kalium sulfat (K2HANYA4 (aq)) dengan wol kaca di ujungnya. Akhirnya, kedua pelat dihubungkan oleh sirkuit eksternal, dengan lampu, yang pencahayaannya akan menunjukkan aliran arus listrik: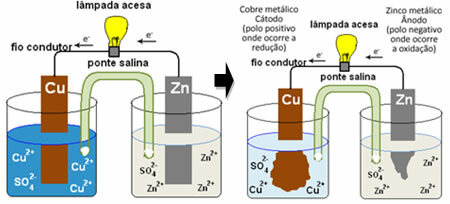
Apa yang terjadi adalah bahwa seng memiliki kecenderungan yang lebih besar untuk teroksidasi, yaitu kehilangan elektron, sehingga logam seng pada bilah bekerja sebagai elektroda negatif, anoda, di mana oksidasi terjadi: Zn(s) Zn2+(sini) + 2 dan-. Elektron yang hilang oleh seng diangkut oleh sirkuit eksternal ke tembaga, menghasilkan arus listrik yang menyalakan lampu. Ion tembaga dalam larutan menerima elektron (mengurangi) dan berubah menjadi tembaga logam yang disimpan pada lembaran tembaga. Ini berarti bahwa ini adalah elektroda positif, katoda, di mana reduksi terjadi: Pantat2+(sini) + 2 dan- pantat(s).
Baterai hari ini memiliki prinsip operasi yang sama, di mana satu logam menyumbangkan elektron ke yang lain, melalui larutan konduktif, dan arus listrik dihasilkan. Bedanya, baterai yang digunakan saat ini kering, karena tidak menggunakan larutan cair sebagai elektrolit, seperti yang terjadi pada baterai Daniell.
Saat ini ada sangat banyak variasi baterai yang dijual secara komersial. Di antara mereka yang paling umum adalah sel asam (dari Leclanché) danbaterai alkalin.
Keduanya memiliki seng sebagai elektroda negatif; Di sisi lain, sebagai kutub positif, ada batang grafit yang dipasang di tengah tumpukan yang dikelilingi oleh mangan dioksida (MnO2), bubuk arang (C) dan pasta basah. Perbedaannya adalah, pada tumpukan asam, amonium klorida (NH) digunakan dalam pasta basah.4Cl) dan seng klorida (ZnCl2) - garam yang bersifat asam - selain air (H2HAI). Dalam baterai alkaline, digunakan kalium hidroksida (KOH), yang merupakan basa.

Baterai Leclanché paling cocok untuk peralatan yang memerlukan pelepasan muatan ringan dan terus menerus, seperti remote control, jam dinding, radio portabel, dan mainan. Baterai alkaline, di sisi lain, memiliki energi 50 hingga 100% lebih banyak daripada baterai biasa dengan ukuran yang sama, direkomendasikan untuk peralatan yang memerlukan pengunduhan yang lebih cepat dan lebih intens seperti radio, pemutar CD/DVD, pemutar MP3 portabel, senter, kamera foto digital dll.

Cari tahu lebih lanjut tentang elektrolit dan elektroda apa yang digunakan dalam baterai ini dan jenis baterai lainnya. untuk jenis peralatan apa yang paling direkomendasikan, baca artikel terkait lebih lanjut di bawah.
Oleh Jennifer Fogaa
Lulus kimia

