Kapasitas yang dimiliki sambungan untuk menarik muatan listrik didefinisikan sebagai Polaritas, yang memiliki karakter berbeda tergantung pada sambungan di mana ia berada.
Mengenai ikatan ionik dan kovalen, yang terakhir membuat molekul menjadi non-polar. Molekul di mana ikatan ion bertanggung jawab untuk menjaga atom bersama memiliki polaritas.
Ikatan yang dominan antara senyawa organik adalah kovalen, sehingga sebagian besar menjadi senyawa nonpolar. Rantai karbon panjang yang ada dalam zat organik tidak memungkinkan mereka memiliki karakter lain selain non-polaritas.
Penjelasannya berasal dari fakta bahwa hubungan terjadi antara elemen yang sama equal (Ç-Ç), oleh karena itu mereka memiliki skala elektronegativitas yang sama. Lihat contoh:

molekul non-polar
Butana yang diwakili oleh struktur di atas adalah gas, perhatikan bahwa atom ikatannya sama (4 karbon terikat bersama).
Tetapi itu tidak berarti bahwa setiap senyawa organik adalah non-polar, kehadiran atom-atom lain di antara karbon memberikan molekul tersebut karakter polar. Lihat contohnya:
Jangan berhenti sekarang... Ada lagi setelah iklan ;)
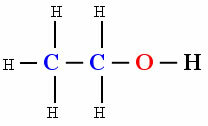
molekul polar
Adanya hidroksil oh (Oksigen terkait dengan hidrogen) menyebabkan molekul senyawa organik Etanol menunjukkan polaritas.
Butana digunakan sebagai gas untuk korek api dan Etanol adalah apa yang disebut alkohol biasa.
Oleh Liria Alves
Lulus kimia
Tim Sekolah Brasil
Lihat lebih banyak!
Sifat senyawa organik
Polaritas – Cari tahu mengapa elektronegativitas mempengaruhi polaritas panggilan.
Polaritas ikatan ion dan kovalenvalen
Kimia organik - Kimia - Sekolah Brasil
Apakah Anda ingin mereferensikan teks ini di sekolah atau karya akademis? Lihat:
SOUZA, Liria Alves de. "Polaritas senyawa organik"; Sekolah Brasil. Tersedia di: https://brasilescola.uol.com.br/quimica/polaridade-dos-compostos-organicos.htm. Diakses pada 28 Juni 2021.