Dalam teks "Elektrolisis Beku”, dijelaskan bahwa proses ini terjadi ketika arus listrik dilewatkan dalam zat cair (dalam keadaan cair), tanpa adanya air dan, dengan cara ini, kation menerima elektron dan anion menyumbangkan elektron, sehingga keduanya memiliki muatan listrik sama dengan nol dan energi terakumulasi.
Untuk lebih memahami bagaimana elektrolisis beku terjadi, mari kita pertimbangkan salah satu contoh paling penting dari jenis proses ini, elektrolisis natrium klorida atau garam meja (NaCl).
Natrium klorida terbentuk di alam melalui transfer elektron dari natrium (Na) ke klor (Cl), seperti reaksi di bawah ini:
2Na(s) + 1Cl2(g) → 2NaCl (s)

Proses ini spontan, tetapi proses kebalikan dari reaksi ini tidak spontan, yaitu produksi gas klor (Cl2(g) – gambar di bawah) dan logam natrium (Na (s)) tidak terjadi di alam. Jika kita ingin ini terjadi, kita harus memulai prosesnya.
Hal ini dapat dilakukan dengan elektrolisis batuan beku. Garam dipanaskan hingga suhu di atas 800,4°C, yang merupakan titik lelehnya; dan dengan cara ini ia menyatu, berpindah dari padat ke cair. Dalam keadaan fisik ini, ion Na Anda
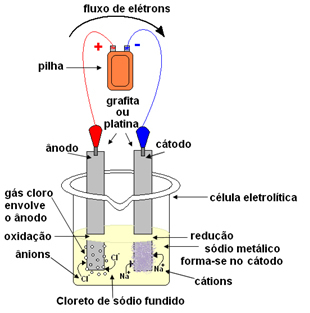
+ dan Cl- bebas.Garam cair kemudian ditempatkan dalam wadah, bejana elektrolit, dan dua elektroda platinum atau grafit inert dicelupkan ke dalam natrium klorida. Elektroda ini terhubung ke sumber yang menghasilkan arus listrik langsung, seperti baterai atau sel.
Dengan berlalunya arus listrik, hal berikut terjadi:
- Kutub negatif baterai atau sel memasok elektron ke salah satu elektroda, yang menjadi katoda;
- Katoda: menerima elektron dari sel dan menjadi kutub negatif, menarik kation Na+, karena muatan yang berlawanan tarik-menarik. Ion-ion ini menerima elektron dari elektroda (katoda) dan terjadi reduksi, membentuk natrium logam:
Pengurangan:Di+(ℓ) + dan- → Dalam(s)
Natrium logam disimpan di atas elektroda dan dikirim ke reservoir.
- Anoda: menjadi bermuatan positif, menarik anion Cl- (karenanya disebut anoda). Ion-ion ini kehilangan elektronnya ketika mereka bersentuhan dengan anoda dan, oleh karena itu, mereka mengalami oksidasi, membentuk atom klor, yang segera bergabung dua per dua untuk membentuk gas klor:
Oksidasi:2Cl-(ℓ) → 2 dan- + 1Cl2(g)
Gas ini menggelegak di sekitar anoda dan dikumpulkan oleh tabung gelas yang disesuaikan dengan sistem.
Dengan demikian, reaksi keseluruhan yang terjadi dalam kasus ini diberikan oleh:
Katoda: 2Na+(ℓ) + 2e- → 2Na(s)
Anoda: 2Cl-(ℓ) → 2 dan- + 1Cl2(g) ____________
Reaksi Global: 2Na+(ℓ) + 2Cl-(ℓ) → 2Na(s) + 1Cl2(g)
Aspek penting lainnya yang harus diperhatikan, yang disorot di akhir teks yang disebutkan (Elektrolisis Beku), adalah bahwa, untuk elektrolisis terjadi, sel atau baterai yang digunakan untuk menghasilkan arus listrik harus mempunyai ddp (beda potensial) sama atau lebih besar dari beda potensial reaksi.
Mari kita lihat ini dalam kasus elektrolisis natrium klorida yang sedang kita pertimbangkan. Untuk mengetahui beda potensial reaksi ini, cukup dengan menurunkan potensial reduksi standar katoda dengan anoda. Hal ini dijelaskan dalam teks. Beda potensial baterai .
Melalui tabel potensial reduksi standar (E0merah), kita tahu bahwa:
Di+(ℓ) + dan- → Dalam(s) DAN0merah = -2,71
2Cl-(ℓ) → 2 dan- + 1Cl2(g) DAN0merah = +1,36
Sekarang, turunkan saja nilai-nilai ini untuk mengetahui perbedaan potensial dari reaksi global:
Dan0 = DAN0merah (katoda) - DAN0merah (anoda)
Dan0 = -2,71 – (+ 1,36)
Dan0 = - 4,07 V
Oleh karena itu, ini berarti bahwa sel atau baterai yang akan digunakan harus memiliki tegangan sama atau lebih besar dari 4,07V untuk melakukan elektrolisis beku natrium klorida.
Nilai negatif hanya menunjukkan bahwa itu adalah proses yang tidak spontan.. Dalam kasus baterai, yang merupakan proses spontan, nilai gaya gerak listrik (∆E0) selalu memberi positif.
Oleh Jennifer Fogaa
Lulus kimia
Sumber: Sekolah Brasil - https://brasilescola.uol.com.br/quimica/eletrolise-Ignea-cloreto-sodio.htm