Joseph Lous Gay-Lussac (1778-1850) adalah seorang ilmuwan yang membuat studi penting tentang gas. Dia melakukan produksi air dari reaksi antara gas hidrogen dan oksigen dan memverifikasi bahwa mereka— selalu bereaksi dengan perbandingan dua volume hidrogen dengan satu volume oksigen, menghasilkan dua volume Air:
Hidrogen + Oksigen → Air
Percobaan Pertama: 2 L 1 L 2 L
Percobaan ke-2: 4 L 2 L 4 L
Percobaan ke-3: 8 L 4 L 8 L
Percobaan ke-4: 16 L 8 L 160 L
Perhatikan bahwa dalam semua percobaan rasionya selalu sama: 2: 1: 2.
Setelah beberapa percobaan dan analisis, menyadari bahwa hal yang sama terjadi dengan jenis lain dari reaksi antara gas, yaitu reaksi selalu mengikuti rasio volume konstan, ilmuwan ini sampai pada hukum reaksi berikut dalam volume gas, yang dikenal sebagai: Hukum Volumetrik Gay-Lussac atau Hukum Kombinasi Volume:

Pernyataan hukum volumetrik Gay-Lussac
Tapi undang-undang ini bertentangan dengan teori atom Dalton, yang mengatakan bahwa segala sesuatu dibentuk oleh partikel bola besar dan tak terpisahkan, atom. Menurut teori ini, volume produk dalam reaksi harus sama dengan jumlah volume reaktan. Dengan demikian, hal-hal berikut harus terjadi:
Hidrogen + Oksigen → Air
2 volume + 1 volume → 3 volume
Tetapi Gay-Lussac menunjukkan bahwa dalam praktiknya tidak demikian, hasilnya sama dengan dua volume uap air.
Jawaban atas kontradiksi yang tampak ini datang melalui hipotesa atau Hukum Avogadro.

Perangko yang dicetak di Italia menunjukkan Amedeo Avogadro dan pengucapan hukumnya, pada tahun 1956*
Amedeo Avogadro (1776-1856) menunjukkan bahwa, pada kenyataannya, gas bukanlah atom yang terisolasi, tetapi molekul (dengan pengecualian gas mulia). Hukumnya berkata:

Pernyataan Hukum Avogadro
Avogadro menunjukkan bahwa 1 mol gas apapun memiliki 6.02. 1023 molekul. Nilai ini dikenal sebagai Bilangan atau konstanta Avogadro. Terbukti bahwa, pada Kondisi Normal Temperatur dan Tekanan (CNTP), di mana tekanannya sama dengan 1 atm dan temperaturnya 273 K (0 °C), volume yang ditempati oleh 1 mol gas apapun akan selalu 22,4 L. Nilai ini sesuai dengan volume molar gas. Hubungan ini sangat penting untuk menyelesaikan latihan exercises stoikiometri.
Ini mungkin tampak aneh, karena pertanyaan berikut mungkin muncul: Bagaimana mungkin gas dengan molekul dan atom dengan ukuran berbeda menempati volume yang sama?
Nah, ini karena jarak molekul gas begitu jauh sehingga ukuran molekulnya bisa diabaikan.
Dengan cara ini, hukum volumetrik Avogadro menjelaskan hukum volumetrik Gay-Lussac. Perhatikan di bawah bahwa dua molekul hidrogen (dua volume) bereaksi dengan satu molekul oksigen (satu volume) untuk membentuk dua molekul air (dua volume). Air dan hidrogen memiliki volume yang sama karena memiliki jumlah molekul yang sama, seperti yang dinyatakan oleh hukum Avogadro.
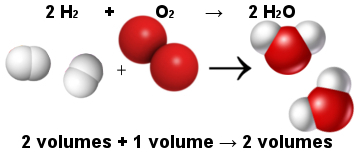
Proporsi antar molekul dalam reaksi pembentukan air
Pada saat yang sama, hukum Avogadro membuat teori atom berdiri, seperti yang Anda lihat bahwa dalam reaktan dan produk ada total 6 atom (4 hidrogen dan 2 oksigen).
Hukum volumetrik ini sangat penting untuk pengembangan konsep molekul.
* Hak cipta gambar: benteng76 / Shutterstock.com
Oleh Jennifer Fogaa
Lulus kimia
Sumber: Sekolah Brasil - https://brasilescola.uol.com.br/quimica/lei-volumetrica-gay-lussac.htm

