Ketika cincin benzena sudah memiliki substituen, radikal ini akan mempengaruhi semua substitusi H lainnya pada cincin. Substituen ini dapat berupa orto dan para-director atau meta-director. Tapi muncul pertanyaan:
| Apa yang menyebabkan gugus yang terikat pada cincin benzena mempengaruhi arah dan reaktivitas reaksi substitusi? |
| Apa yang membuat penasihat tujuan kelompok tertentu (menonaktifkan) dan yang lainnya orto-para (mengaktifkan)? |
Kedua pertanyaan ini dijawab dengan memahami pemanggilan. efek elektronik bahwa kelompok-kelompok ini latihan di atas ring. Efek ini terjadi karena perbedaan keelektronegatifan antara unsur-unsur, sebagai substituen akan mempolarisasi ikatan inti aromatik, secara bergantian menginduksi karakter positif ke beberapa cincin karbon, sementara yang lain tetap dengan karakter negatif.
| Substitusi baru akan terjadi pada atom karbon yang memiliki karakter negatif. |
Mari kita lihat bagaimana efek elektronik ini terjadi pada cincin aromatik, dengan mengingat urutan keelektronegatifan unsur: F > O > N > Cl > Br > S > C > I > H.
Kasus pertama: Pengaktifan radikal atau orto-ke-sutradara:
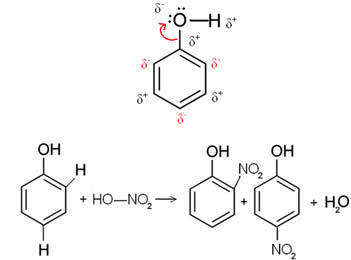
Misalnya, dalam kasus di bawah molekul benzol (fenol), oksigen adalah unsur yang paling elektronegatif, jadi itu menarik elektron ke dirinya sendiri, menyebabkan karbon memiliki muatan sebagian positif, yang menginduksi polarisasi cincin bolak-balik. Posisi yang negatif persis posisi orto dan para. Itulah mengapa gugus -OH adalah radikal pengaktif atau orto-ke-direktur. Hal ini dapat dilihat pada reaksi nitrasi fenol di bawah ini, menghasilkan o-nitrofenol dan p-nitrofenol sebagai produk:
Kasus kedua: menonaktifkan radikal atau meta-pemimpin:
Sekarang perhatikan kasus nitrobenzena:
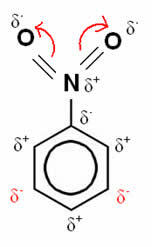
Dalam contoh ini, oksigen tetap menjadi unsur yang paling elektronegatif, sehingga ia menarik ikatan yang dibuat dengan nitrogen ke dirinya sendiri, yang sebagian bermuatan positif, menginduksi atom karbon yang melekat padanya menjadi terpolarisasi negatif dan sebagainya berturut-turut. Dengan demikian, posisi yang menjadi negatif dan paling rentan terhadap substitusi adalah posisi tujuan, menjadi, oleh karena itu, a melumpuhkan.
Lihat sekarang secara lebih rinci efek elektronik ini, yang disebut efek resonansi.
| efek resonansi itu adalah daya tarik atau tolak-menolak elektron pada ikatan of (pi) dari ikatan rangkap dua atau rangkap tiga, ketika mereka beresonansi dengan cincin benzena itu sendiri. |
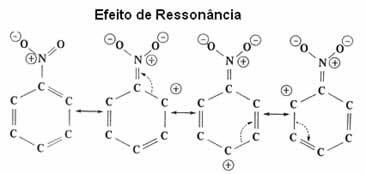
Seperti yang terlihat, gugus NO2 menonaktifkan cincin, karena mengambil elektron darinya dan mengurangi kerapatan elektronnya. Dengan demikian, gugus yang akan menyerang dan melakukan substitusi (elektrofil) adalah positif, sehingga lebih disukai menyerang posisi meta yang bermuatan negatif.
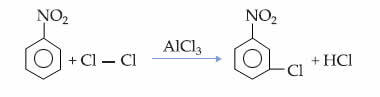
Fakta ini dapat dilihat pada reaksi monoklorinasi nitrobenzena, di mana substitusi hanya terjadi pada posisi meta:
Oleh Jennifer Fogaa
Lulus kimia
Tim Sekolah Brasil
Sumber: Sekolah Brasil - https://brasilescola.uol.com.br/quimica/efeitos-eletronicos-radicais-meta-orto-para-dirigentes.htm