Di laboratorium dan industri kimia, sangat penting untuk mengetahui jumlah zat yang terlibat dalam reaksi. Oleh karena itu, di bawah ini kita akan membahas konsep utama, besaran, dan satuan ukuran yang berkaitan dengan massa atom:
- Satuan Massa Atom (u):
Atom referensi berat standar untuk menentukan satuan massa atom adalah karbon-12 (12). Satuan massa atom (1 u) sesuai dengan nilai 1,66054. 10-24 g, yang merupakan massa 1/12 isotop karbon dengan massa sama dengan 12 (12).
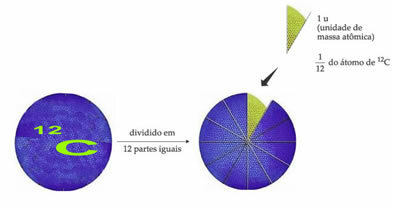
Satuan massa atom (u) adalah satuan yang digunakan untuk semua besaran yang tercantum di bawah ini.
- Massa Atom dari Atom atau Isotop (MA):
Itu diperoleh dengan membandingkannya dengan nilai referensi yang disebutkan pada item sebelumnya. Misalnya, massa atom 919F diberikan oleh spektrometer massa, yang sama dengan 18,9984 u. Pembulatan ke atas sama dengan 19, yang merupakan nilai yang sama dengan nomor massanya (A). Nilai ini berarti bahwa massa atom unsur 919F 19 kali lebih besar dari massa 1/12 12.
- Massa Atom suatu Unsur (AM):
Massa atom unsur ditentukan oleh rata-rata tertimbang massa atom isotopnya. Ini dilakukan dengan mengalikan massa atom setiap isotop dengan persentase yang muncul dalam konstitusi elemen. Nilai-nilai ini kemudian dijumlahkan, yang dibagi dengan 100, menghasilkan persentase total.
Misalnya, elemen neon terdiri dari tiga isotop dengan massa atom dan persentase berikut dalam konstitusinya:

Menghitung massa atom (MA) unsur ini:
BURUKneon = (20. 90,92) + (21. 0,26) + (22. 8,82)
100
BURUKneon = 20.179 u
- Massa Molekul (MM):
Seperti namanya, ini digunakan untuk zat molekuler, yaitu atom yang dihubungkan melalui penggunaan bersama pasangan elektron, yang disebut ikatan kovalen.
Massa molekul diperoleh dengan mengalikan jumlah atom setiap unsur dengan massa atomnya dan menjumlahkan hasilnya.
Misalnya, molekul CO2 mengandung satu karbon dan dua oksigen, jadi kita akan mengalikan massa atom karbon dengan 1; dan oksigen menjadi dua, menambahkannya nanti:
MMCO2 = (1. BURUKÇ) + (2. BURUKHAI)
MMCO2 = (1. 12) + (2. 16)
MMCO2 = 12 + 32
MMCO2 = 44 u
- Rumus Massa:
Ini adalah perhitungan yang sama yang dilakukan untuk massa molekul, namun, untuk senyawa ionik. Dalam hal ini namanya berbeda karena tidak dikelompokkan menjadi molekul, tetapi menjadi gugus ion. Karena molekul tidak ada, jelas tidak ada gunanya berbicara tentang massa molekul, tetapi alasan di balik perhitungannya adalah sama.
Contoh:
NaCl
↓ ↓
23 +35,5 → Massa rumus = 58,5 u
Oleh Jennifer Fogaa
Lulus kimia
Sumber: Sekolah Brasil - https://brasilescola.uol.com.br/quimica/massas-dos-atomos.htm
