Di ikatan kovalen, disebut juga ikatan molekul atau homopolar, adalah yang terjadi di antara atom-atom dari unsur elektronegatif, yaitu, dengan kecenderungan untuk menerima elektron, membentuk ikatan berbagi elektron dari kulit valensinya.
Ikatan kovalen dapat terjadi antara unsur-unsur berikut: hidrogen, nonlogam, dan semilogam. Logam tidak pernah berpartisipasi dalam jenis ikatan ini.
Mari kita perhatikan contoh sederhana dari ikatan kovalen: ikatan pembentuk gas hidrogen (H2):
H + H → H2
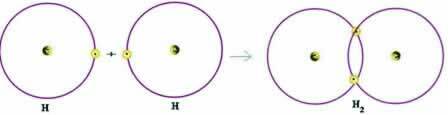
Perhatikan bahwa kedua atom perlu menerima elektron untuk melengkapi kulit valensinya – menurut Aturan Oktet – dan, dengan cara ini, agar tetap stabil. Oleh karena itu, mereka berbagi elektron dan, dengan cara ini, mereka berdua memiliki dua elektron, memiliki kulit K lengkap dan memperoleh konfigurasi helium gas mulia.
Pembagian elektron inilah yang membedakan jenis ikatan ini dari ikatan ionik, di mana transfer elektron terjadi.
Lihat gambar di bawah untuk dua contoh lagi dari kasus ini:
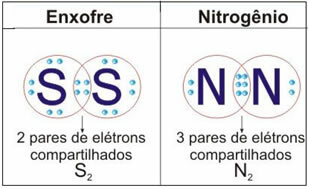
Dalam jenis ikatan ini terjadi pembentukan molekul, yang dapat diwakili oleh masing-masing
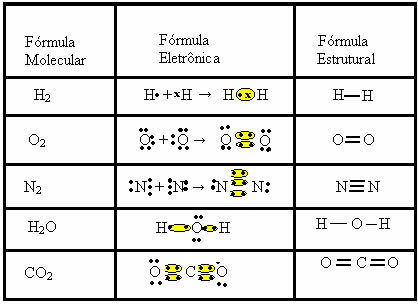
rumus molekul, yaitu, representasi paling sederhana yang menunjukkan berapa banyak atom dari setiap elemen yang ada dalam molekul. Beberapa contoh rumus molekul adalah: H2, S2, O2, tidak2, H2O, CO2, dll.Ikatan kovalen dapat diwakili oleh dua rumus lain:
- Rumus Elektronik atau Rumus Lewis: dalam rumus ini juga muncul elektron dari kulit valensi masing-masing atom dan pembentukan pasangan elektron. Elektron ini dilambangkan dengan tanda . atau x;
- Rumus Struktur Datar atau Rumus Struktur Couper: menunjukkan tautan elemen, dengan setiap pasangan yang dibagikan sesuai dengan tanda hubung. Jika itu hanya tanda hubung, kami menyebutnya tautan tunggal; jika ada dua, ikatan rangkap; dan jika ada tiga garis putus-putus, ikatan rangkap tiga.
Lihatlah contoh lain dari ikatan kovalen yang diwakili oleh tiga rumus kimia ini:
Oleh Jennifer Fogaa
Lulus kimia
Sumber: Sekolah Brasil - https://brasilescola.uol.com.br/quimica/ligacoes-covalentes.htm
