Lorenzo Romano Amedeo Carlo Avogadro (1776-1856) adalah seorang ahli kimia Italia yang pertama kali menetapkan gagasan bahwa sampel suatu unsur, dengan massa dalam gram yang secara numerik sama dengan massa atomnya, selalu memiliki jumlah atom yang sama (N).
Avogadro sendiri tidak dapat menentukan nilai N. Namun, sepanjang abad kedua puluh, kemajuan teknologi dan pengetahuan ilmiah memungkinkan ilmuwan lain mengembangkan teknik untuk menentukannya. Ketika nilai ini akhirnya ditemukan, itu disebut Konstanta Avogadro, untuk menghormati ilmuwan ini, karena dialah yang meletakkan dasar untuk penciptaannya.

Lorenzo Romano Amedeo Carlo Avogadro (1776-1856)
Dalam 1 mol entitas apa pun (atom, molekul, elektron, rumus atau ion) terkandung persis nilai konstanta Avogadro.
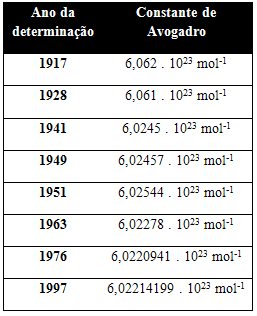
Tabel di bawah ini menunjukkan beberapa nilai konstanta Avogadro yang diperoleh sepanjang abad ke-20:
Berikut adalah beberapa teknik yang digunakan untuk mencoba menentukan nilai konstanta Avogadro:
Ilmuwan pertama yang membuat perhitungan perkiraan untuk konstanta Avogadro adalah Johann Joseph Loschmidt. Pada tahun 1867, ia mendasarkan dirinya pada teori kinetik gas dan menentukan berapa banyak molekul yang ada dalam 1 cm
3 dari sebuah gas.Ilmuwan lainnya adalah orang Prancis Jean Baptiste Perrin (1870-1942) yang menghitung jumlah partikel koloid per satuan volume dalam suspensi dan mengukur massanya. Nilai yang dia temukan adalah antara 6,5 dan 7,2. 1023 entitas per mol. Ilmuwan ini menerbitkan, pada tahun 1913, buku Les Atomes (1 edisi Paris: Alcan), dan edisi ke-9, yang diterbitkan pada tahun 1924, berisi 16 cara untuk mendapatkan konstanta Avogadro secara eksperimental.

Jean Baptiste Perrin (1870-1942)
Bertahun-tahun kemudian, ilmuwan James Dewar (1842-1923) menggunakan metode yang dikembangkan bertahun-tahun sebelumnya oleh ahli radiokimia Bertram Boltwood (1870-1927) dan fisikawan Ernest Rutherford (1871-1937), yang pada dasarnya terdiri dari menghitung partikel alfa yang dipancarkan oleh sumber radioaktif dan menentukan volume gas helium yang diperoleh. Nilai yang ditemukan Dewar adalah 6,04. 1023 mol-1.
Kembali pada abad ke-20, Robert Millikan (1868-1953) melakukan percobaan untuk menentukan muatan elektron (1.6. 10-19 ). Karena muatan 1 mol elektron sudah diketahui (96500 C), kedua nilai ini dapat dihubungkan dan menemukan nilai konstanta Avogadro berikut: 6,03. 1023 mol-1.
Saat ini, nilai yang direkomendasikan untuk konstanta Avogadro adalah 6.02214 x 1023 mol-1 dan itu ditentukan dengan cara difraksi sinar-X, di mana volume beberapa atom kisi kristal diperoleh, selama kerapatan dan massa 1 mol atom dalam sampel diketahui.
Untuk tujuan didaktik, di Sekolah Menengah, di mana perhitungan tidak perlu seakurat yang dilakukan di laboratorium kimia, konstanta Avogadro dianggap sebagai 6,02. 1023 mol-1.
Ada juga metode sederhana yang dapat digunakan untuk membantu siswa menentukan konstanta Avogadro dalam praktik. Salah satunya adalah melalui elektrolisis dalam media berair.
Oleh Jennifer Fogaa
Lulus kimia
Sumber: Sekolah Brasil - https://brasilescola.uol.com.br/quimica/determinacao-constante-avogadro.htm