Teori Hibridisasi muncul sebagai pelengkap dari Teori Oktet, berhasil menjelaskan struktur sejumlah besar molekul, termasuk molekul yang dibentuk oleh boron (B).
Unsur ini memiliki lima elektron keadaan dasar, dengan konfigurasi elektron sebagai berikut:
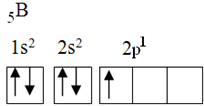
Menurut teori oktet, boron hanya dapat membuat satu ikatan kovalen, karena hanya memiliki satu orbital atom yang tidak lengkap. Namun, secara eksperimental, diketahui bahwa unsur ini membentuk senyawa di mana ia melakukan lebih dari satu ikatan.
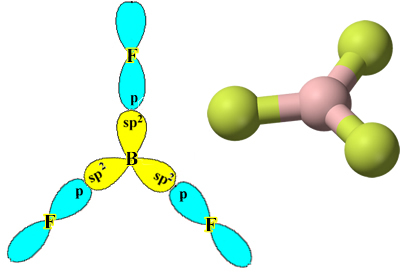
Contohnya adalah boron trifluorida (BF3). Seperti yang ditunjukkan di bawah ini, boron membuat tiga ikatan kovalen dengan fluor, berbagi tiga pasang elektron dan meninggalkan enam elektron di kulit terakhirnya (lapisan valensi), yaitu pengecualian terhadap aturan oktet.
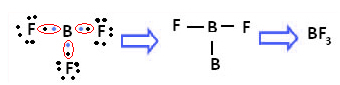
Ini dijelaskan oleh fenomena hibridisasi yang terjadi dengan boron. Ternyata elektron dari sublevel 2s menyerap energi dan masuk ke keadaan tereksitasi, di mana ia melompat ke orbital kosong dari sublevel 2p. Dengan demikian, tiga orbital tidak lengkap terbentuk, yang sekarang dapat membuat tiga ikatan kovalen:
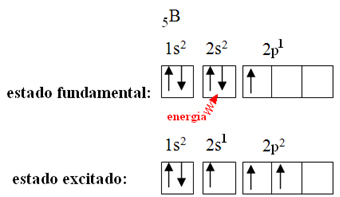
Namun, ikatan yang terbentuk pada boron trifluorida semuanya sama, tetapi jika kita perhatikan di atas, ada dua ikatan berbeda, karena salah satunya akan dibuat melalui orbital s dan dua lainnya melalui orbital sejenis. ketik hal. Di sinilah hibridisasi terjadi, yaitu orbital yang tidak lengkap bergabung, menghasilkan tiga orbital hibrida atau hibridisasi, yang identik dan berbeda dari aslinya:
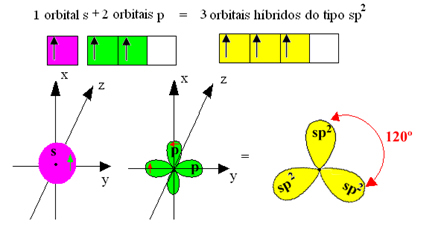
Karena orbital hibrid ini terdiri dari satu orbital s dan dua orbital p, hibridisasi ini disebut hibridisasi sp².
Fluor yang mengikat boron memiliki sembilan elektron. Distribusi elektronik dan orbitalnya ditunjukkan di bawah ini:
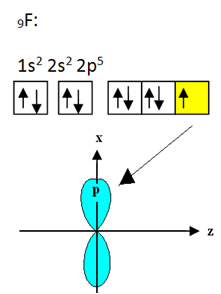
Perhatikan bahwa setiap atom fluor hanya dapat membuat satu ikatan kovalen dan orbital yang membuat ikatan ini bertipe p. Jadi, perhatikan di bawah ini bagaimana orbital terbentuk saat membuat koneksi yang membentuk BF3 dan lihat bagaimana tautannya identik, seperti σp-sp2:
Ini juga terjadi dengan elemen lain, lihat, misalnya, teks “Hibridisasi Berilium”.
Oleh Jennifer Fogaa
Lulus kimia
Sumber: Sekolah Brasil - https://brasilescola.uol.com.br/quimica/hibridizacao-boro.htm
