Biasanya reaksi dari elektrolisis air dan elektrolisis beku mereka dilakukan dengan elektroda grafit dan platinum, yang tidak berpartisipasi dalam reaksi; mereka hanya menghantarkan arus listrik. Namun, ada beberapa kasus khusus di mana perlu digunakan elektroda aktif, yaitu yang mengalami reduksi dan oksidasi.
Kasus penggunaan utama elektroda ini yang berpartisipasi dalam proses redoks adalah: a pemurnian logam elektrolitik, seperti seng, kobalt, nikel dan terutama tembaga; dan juga pelapisan listrik. Mari kita lihat bagaimana setiap kasus terjadi:
• Pemurnian Elektrolit Tembaga: pemurnian tembaga elektrolitik ini dapat menghasilkan kemurnian sekitar 99,9% dan terutama digunakan untuk membuat kabel tembaga yang, jika memiliki jumlah pengotor paling sedikit, mungkin memiliki kemampuan untuk menghantarkan arus listrik yang sangat tinggi berkurang.
Amati bagaimana proses ini terjadi, lihat skema tong elektrolit yang dirakit di bawah ini:

Perbedaan potensial diterapkan pada larutan berair Tembaga Sulfat (CuSo
4 (aq)) – yang menghantarkan listrik – sehingga anoda, yang merupakan logam tembaga tidak murni, kehilangan elektron, yaitu mengalami oksidasi, melepaskan kationnya (Cu2+), yang diendapkan pada pelat negatif. Ini bisa berupa pelat platina inert, atau, lebih baik lagi, pelat tembaga murni. Ini merupakan katoda, yang direduksi ketika tembaga disimpan di dalamnya. Dengan demikian, semi-reaksi yang terjadi pada elektroda adalah: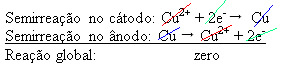
Fakta bahwa itu memberikan hasil nol menunjukkan bahwa tidak ada reaksi kimia, tetapi hanya pengangkutan tembaga. Di bagian bawah wadah terdapat zat-zat najis lainnya yang ada di dalam tembaga seperti emas, perak, silika (pasir) dan mineral lainnya, yang bahkan dapat dijual.
• Elektroplating: lapisan logam diterapkan pada bahan yang akan dilindungi dari korosi.
Logam yang dipilih untuk pelapis - yang dapat berupa krom (krom), nikel (nikel), perak (perak), emas (penyepuhan) atau seng (galvanisasi) – akan menjadi anoda, elektroda positif, yang mengalami oksidasi, kehilangan elektron. Ia mengalami oksidasi menggantikan bahan yang telah dilindungi, karena potensi reduksinya lebih besar.
Elektroda negatif, yaitu katoda, yang menerima elektron ini dan mengalami reduksi, adalah bahan itu sendiri yang dilapisi. Dengan cara ini, ia tetap terlindungi bahkan jika permukaannya entah bagaimana dilanggar.
Oleh Jennifer Fogaa
Lulus kimia
Sumber: Sekolah Brasil - https://brasilescola.uol.com.br/quimica/eletrolise-com-eletrodos-ativos.htm