Dalam teks "Konsentrasi dalam mol/L atau MolaritasAnda melihat bahwa konsentrasi dalam mol/L berhubungan dengan jumlah materi dalam zat terlarut (n1, diukur dalam mol) dengan volume larutan dalam liter (V). Namun, ada beberapa zat terlarut yang, ketika ditempatkan dalam air, menghasilkan ion.
Contohnya adalah ketika kita memasukkan garam (NaCl) ke dalam air, terjadi gaya tarik menarik antara kutub positif air dengan Cl dan kutub negatif dengan Na sehingga menimbulkan ion Na+ dan Cl-.
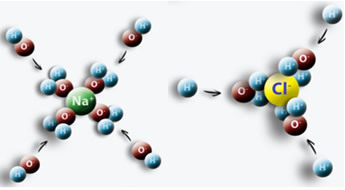
Penting untuk mengetahui bagaimana menentukan konsentrasi dalam mol/L ion-ion ini, karena ini dapat berguna dalam banyak situasi. Salah satu bidang yang menggunakan ini adalah obat-obatan, terutama dalam tes darah medis. Darah kita dan cairan tubuh lainnya memiliki ion terlarut di dalamnya. Jika konsentrasi ion-ion ini dalam darah kita di atas atau di bawah normal, itu dapat mengganggu fungsi tubuh kita dan menyebabkan gangguan dan penyakit.
Lihat kasus ion besi (Fe2+): jika orang tersebut kekurangan ion ini, ia dapat mengalami anemia. Jadi, ketika seseorang yang menderita anemia diberitahu bahwa mereka perlu mengonsumsi makanan kaya zat besi atau bahkan obat yang mengandung zat besi, itu sebenarnya ion besi dan bukan unsur logam.
Lain halnya bila terjadi kehilangan ion kalsium (Ca2+) pada tulang, menyebabkan osteoporosis, seperti terlihat pada foto dengan gambar tulang yang diperbesar di bawah ini:

Lihat contoh ion lain yang memiliki fungsi vital dalam tubuh kita dan harus dalam konsentrasi yang benar:

Oleh karena itu, dengan informasi ini, menjadi jelas bahwa mengetahui bagaimana menghitung konsentrasi ion dalam larutan sangat penting. Tapi bagaimana ini bisa dilakukan?
Dimungkinkan untuk menentukan konsentrasi dalam mol/L ion yang ada dalam larutan jika dua data penting diketahui, yaitu:
- Rumus zat terlarut dalam air;
- Molaritas solusi Anda.
Dengan data ini di tangan, tulis persamaan disosiasi atau ionisasi dari zat terlarut tersebut dan temukan dengan pengurangan konsentrasi ion, sebagai sebanding dengan jumlah mol masing-masing ion. Ini berarti bahwa konsentrasi ion sebanding dengan koefisien masing-masing dalam persamaan ionisasi atau disosiasi.
Lihat contoh berikut untuk lebih memahami bagaimana perhitungan ini dilakukan:
"Pertimbangkan bahwa konsentrasi dalam jumlah materi dari larutan magnesium fosfat (Mg .) berair yang diberikan3(DEBU4)2 adalah 0,5 mol/L. Berapa konsentrasi dalam mol/L kation magnesium (Mg2+(sini)) dan anion fosfat (PO3-4 (aq)) dalam larutan ini, mengingat derajat disosiasi (α) adalah 100%?”
Langkah pertama dalam menyelesaikan soal ini adalah dengan menulis persamaan disosiasi atau ionisasi. Jika Anda mengalami kesulitan, Anda dapat mendasarkan diri pada persamaan umum di bawah ini:
1 AxBkamu → x A+ y + y B-x
1 mol x mol y mol
Jadi, mengingat dalam contoh ini bahwa magnesium fosfat terdisosiasi sepenuhnya, kita memiliki persamaan berikut:
1 mg3(DEBU4)2 (aq) → 3 mg2+(sini) + 2 gp3-4 (aq)
1 mol 3 mol 2 mol
Kita dapat melihat bahwa 1 mol Mg3(DEBU4)2 menghasilkan 3 mol Mg2+(sini) dan 2 mol PO3-4 (aq); jadi, jumlah mol kation akan menjadi 3 kali jumlah mol fosfat yang digunakan untuk membuat larutan, dan jumlah anion akan menjadi 2 kali.
Karena larutannya adalah 0,5 mol/L Mg3(DEBU4)2 (aq) , ini berarti bahwa 0,5 mol Mg dilarutkan dalam 1 L itu3(DEBU4)2, yang menghasilkan 1,5 mol/L Mg2+(sini) dan 1,0 mol/L PO3-4 (aq):
1 mg3(DEBU4)2 (aq) → 3 mg2+(sini) + 2 gp3-4 (aq)
1 mol 3 mol 2 mol
0,5 mol x y
1. 0,5 3. 0,5 2. 0,5
0,5 mol/L 1,5 mol/L1,0 mol/L
Namun bagaimana jika derajat disosiasi atau ionisasinya tidak 100%? Katakanlah 70%, bagaimana kita mencari tahu konsentrasi mol/L ion-ion ini?
Dalam hal ini, lakukan saja aturan sederhana tiga. Lihat di bawah:
1,5 mol/L Mg2+(sini) 100 %
x 70%
x = 70. 1,5 → x = 1,05 mol/L ion Mg2+(sini)
100
1,5 mol/L PO3-4 (aq) 100 %
y 70%
y = 70. 1,0 → y = 0,70 mol/L ion PO3-4 (aq)
100
Oleh Jennifer Fogaa
Lulus kimia
Sumber: Sekolah Brasil - https://brasilescola.uol.com.br/quimica/concentracao-dos-ions-mol-l.htm

