Ketika kita memasak makanan di rumah kita, kita menggunakan pembakaran gas memasak. Salah satu hal yang dapat kita lihat pada nyala api yang dihasilkan dari pembakaran gas ini adalah warnanya yang biasanya biru muda. Namun, dalam sebagian besar reaksi pembakaran, seperti membakar lilin, nyala api berwarna kuning.

Kemudian muncul pertanyaan:
"Jika setiap api adalah hasil dari reaksi pembakaran, mengapa beberapa api memiliki warna yang berbeda?"
Untuk memahami bagaimana ini terjadi, kita harus memahami apa itu reaksi pembakaran, dan zat apa yang ada dalam setiap reaksi yang disebutkan.
Reaksi pembakaran terjadi ketika bahan bakar (bahan teroksidasi) dikonsumsi oleh oksidator (bahan gas yang mengandung oksigen) untuk menghasilkan energi panas (panas).
Hal penting lainnya yang perlu kita ketahui tentang reaksi pembakaran adalah bahwa reaksi tersebut dapat berlangsung di a lengkap atau tidak lengkap. Jika ada cukup oksigen untuk mengkonsumsi bahan bakar, reaksi akan selesai dan menghasilkan karbon dioksida (CO .).
2) dan air (H2HAI). Jika tidak, pembakaran akan parsial, tidak lengkap, menghasilkan karbon monoksida (CO) dan air; atau karbon (C) dan air.Dalam kedua kasus yang kami analisis, pengoksidasi adalah oksigen yang ada di udara. Namun, bahan bakarnya berbeda. Gas memasak sebenarnya adalah liquefied petroleum gas (LPG), yang merupakan campuran dari hidrokarbon (alkana), bahan bakar utamanya adalah butana (C4H10). Jadi, gas memasak terdiri dari molekul alkana yang hanya memiliki tiga atau empat atom karbon, itulah sebabnya sedikit oksigen yang dibutuhkan agar pembakarannya berlangsung sempurna. Reaksi ini dapat dinyatakan sebagai berikut:
1C4H10 (g) + 13/2 O2 (g) → 4 CO2 (g) + 5 jam2HAI(g), H < 0
Dalam kasus lilin, parafin adalah bahan bakar untuk reaksi, dan terdiri dari campuran alkana dengan atom karbon yang berkisar antara 20 hingga 36. Dengan demikian, dibutuhkan lebih banyak oksigen agar reaksi ini terjadi sepenuhnya. Lihat contoh:
1C24H50(s) + 70/2 O2 (g) → 25 CO2 (g) + 25 H2HAI(g), H < 0
Di udara tidak ada cukup oksigen untuk melakukan pembakaran sempurna ini, sehingga berlangsung tidak sempurna, seperti gambar di bawah ini:
1C24H50(s) +49/2 O2 (g) → 24 CO(g) + 25 H2HAI(g), H < 0
1C24H50(s) +25/2 O2 (g) → 24C(s) + 25 H2HAI(g), H < 0
Reaksi tidak sempurna menghasilkan lebih sedikit energi daripada pembakaran sempurna. Ini menjelaskan perbedaan antara warna nyala api, karena nyala kuning, karakteristik pembakaran tidak sempurna, memiliki energi yang lebih rendah. Api biru adalah karakteristik dari pembakaran sempurna, dengan energi yang lebih besar.
Ini juga menjelaskan pembentukan jelaga oleh nyala lilin (gambar di bawah), yang merupakan karbon yang dianggap sebagai produk pembakaran tidak sempurna.
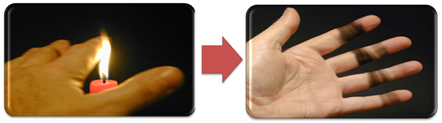
Tapi mengapa, di pembakar Bunsen, mungkin untuk mendapatkan api kuning dan biru ketika bahan bakar tidak berubah?
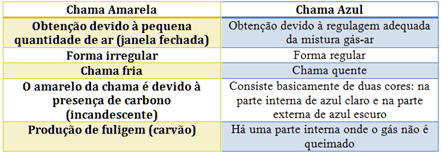
Dalam kasus pembakar Bunsen, ini dicapai dengan mengatur saluran masuk gas dan udara. Jika jendela tertutup, menyebabkan masuknya sedikit udara, nyala api yang diperoleh akan berwarna kuning, karena akan memiliki sedikit oksigen untuk melakukan pembakaran yang sempurna. Jika pengaturan campuran gas-udara memadai, kita mendapatkan nyala biru.
Lihat karakteristik masing-masing pada tabel di bawah ini:
Oleh Jennifer Fogaa
Lulus kimia
Sumber: Sekolah Brasil - https://brasilescola.uol.com.br/quimica/combustao-chamas-cores-diferentes.htm
