Karbonat adalah senyawa anorganik yang dibentuk oleh ikatan ion logam atau semilogam dengan anion karbonat, CO32-.
Karbon adalah tetravalen, yaitu memiliki empat elektron di kulit valensi, dan dapat membuat empat ikatan kovalen menjadi stabil, sedangkan oksigen bivalen, memiliki enam elektron di kulit valensi dan mampu membuat dua ikatan menjadi stabil, dengan delapan elektron. Dengan demikian, ada kecenderungan kuat bagi karbon untuk berikatan dengan dua atom oksigen, yang semuanya stabil (O C O → BERSAMA2).
Tetapi oksigen lain dapat bergabung dengan karbon, karena rasio jari-jari ion menghasilkan bilangan koordinasi yang sama dengan 3, membentuk struktur segitiga di mana karbon berada di tengah, membuat ikatan rangkap dengan salah satu atom oksigen dan dua ikatan tunggal dengan dua lainnya oksigen. Hasilnya adalah dua elektron berlebih, karena kedua oksigen ini tidak stabil, masing-masing perlu menerima satu elektron:
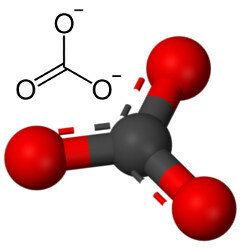
Anion karbonat dibentuk oleh ikatan kovalen, tetapi senyawanya, yang merupakan garam dan mineral anorganik dikenal sebagai karbonat, bersifat ionik, karena radikal ini menerima dua elektron dari beberapa logam atau semilogam, membentuk a ikatan ion.
Senyawa ini tidak larut dalam air, kecuali amonium karbonat ((NH4)2BERSAMA3) dan karbonat yang dibentuk dengan logam alkali (elemen dari keluarga 1: Li, Na, K, Rb, Cs dan Fr). Hampir semuanya adalah padatan putih, seperti yang ditunjukkan pada gambar di bawah ini:

Dua contoh karbonat sehari-hari yang paling umum dan paling penting adalah natrium karbonat (Na2BERSAMA3) dan kalsium karbonat (CaCO3). Dalam kasus pertama, natrium milik keluarga 1, memiliki elektron di kulit valensi dan cenderung kehilangan elektron ini menjadi stabil. Karena anion karbonat perlu menerima dua elektron, ia mengikat dua atom natrium:

Soda ash lebih dikenal sebagai soda atau soda, digunakan dalam pembuatan sabun, pewarna, obat-obatan, kertas dan dalam perawatan air kolam renang. Namun aplikasi utamanya adalah dengan kalsium karbonat dan pasir dalam pembuatan kaca.
Kalsium adalah keluarga 2, memiliki kecenderungan untuk kehilangan dua elektron. Jadi, atom kalsium berikatan dengan radikal karbonat:

Kalsium karbonat hadir dalam batu kapur dan marmer. Di stalaktit dan stalagmit yang ada di gua-gua tersusun dari karbonat ini; kerang, terumbu karang dan kulit telur juga. Ketika kita mengapur dinding, batang pohon dan tempat lain, kita menggunakan kalsium hidroksida (Ca(OH)2), yang dari waktu ke waktu bereaksi dengan karbon dioksida atmosfer untuk membentuk kalsium karbonat.

Karbonat sangat umum di permukaan bumi, seperti halnya mineral. Retikulum kristalnya dapat mengatur ulang dirinya sendiri di ruang angkasa dalam dua cara: ortorombik (seperti halnya dengan mineral aragonit yang ditunjukkan di atas bersama dengan rumus kalsium karbonat) dan rombohedral atau trigonal, seperti halnya kalsit (mineral lain yang terdiri dari kalsium karbonat).
Karbonat bereaksi dengan adanya asam, melepaskan CO2, yang mudah dilihat melalui buih.
Oleh Jennifer Fogaa
Lulus kimia

