NS Semacam spagetiatom, seperti namanya, itu adalah massa atom, biasanya dilambangkan dengan “mNS” atau “MA”. Namun, karena atom adalah entitas yang sangat kecil, tidak terlihat oleh mata manusia, misalnya, tidak mungkin mengukur massanya menggunakan timbangan. Jadi para ilmuwan menentukan massa atom dengan membandingkannya dengan massa atom lain.
Ini juga dilakukan dengan unit lain. Misalnya, satuan massa adalah kilogram standar, yang sesuai dengan tinggi dan diameter silinder 3,917 cm, terbuat dari 10% iridium dan 90% platinum. Jadi ini berfungsi sebagai perbandingan. Misalnya, jika kita “menimbang” sebuah benda pada sebuah timbangan dan ternyata massanya 10 kg, itu berarti massanya 10 kali lebih besar dari standar yang dipilih: 1 kg.
Hal yang sama berlaku untuk atom. Standar yang dipilih adalah karbon-12, dan atom ini secara sewenang-wenang diberi massa 12 u. "u" adalah satuan massa atom dan karenanya setara dengan 1/12 massa atom karbon.
Misalnya, ketika kita mengatakan bahwa massa atom hidrogen sama dengan 1 u, itu berarti seolah-olah jika kita membagi karbon menjadi 12 bagian, massa salah satu bagian ini sama dengan massa atom hidrogen. Contoh lain adalah belerang, massa atomnya adalah 32 u, yang berarti massanya 32 kali lebih besar dari 1/12 massa
12C.1 u = 1/12 massa 1 atom karbon 12

Satuan massa atom adalah 1/12 massa karbon-12
Massa molekul zat adalah jumlah massa atom unsur-unsur. Misalnya massa atom oksigen sama dengan 16 u, maka massa molekul molekul gas oksigen (O2) sama dengan 32u.
Karena teknik laboratorium saat ini sangat maju, ada perangkat yang secara akurat mengukur massa atom unsur, seperti spektrometer massa. Dengan demikian, adalah mungkin untuk mengetahui bahwa 1 u sama dengan 1,66054. 10-24 G.
Peta Pikiran: Massa Atom

*Untuk mengunduh peta pikiran dalam PDF, Klik disini!
Karena massa atom ditentukan dengan sangat presisi, mereka diberikan dalam tabel periodik dalam bentuk angka desimal. Tetapi ketika kita melakukan perhitungan, kita biasanya menggunakan angka yang dibulatkan, dengan pengecualian eksperimen yang harus sangat presisi. Misalnya, jika Anda melihat Tabel Periodik, Anda akan melihat bahwa massa atom oksigen sama dengan 15.999 u, tetapi kami biasanya menggunakan nilai 16 u dalam perhitungan. Ini juga terjadi pada karbon, yang massa atomnya diberikan oleh 12,01 u, seperti yang ditunjukkan di bawah ini:
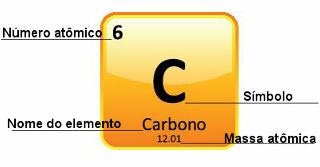
Representasi karbon dalam Tabel Periodik
Unsur-unsur yang muncul dalam Tabel Periodik sebenarnya adalah rata-rata tertimbang dari semua isotop alami unsur tersebut. Dengan demikian, massa atom yang muncul pada Tabel juga merupakan rata-rata massa atom unsur-unsur tersebut. Misalnya, klorin (C?) memiliki dua isotop alami, 35 dan 37, yang persentasenya masing-masing di alam adalah 75,76% dan 24,24%. Massa atom masing-masing isotop ini berbeda, dengan C?-35 menjadi 34.96885 u dan C?-37 menjadi 36.96590.
Dengan cara ini, massa atom unsur dihitung dengan mempertimbangkan massa masing-masing isotop dan kelimpahan yang muncul di alam. Dalam kasus klorin, kami memiliki:
Massa atom unsur klorin = (34,96885. 75,76%) + (36,96590. 24,24%)
100%
Massa atom unsur klorin = 35,45
Ini adalah nilai massa atom klorin yang muncul pada Tabel Periodik.
* Mind Map oleh Saya Diogo Lopes
Oleh Jennifer Fogaa
Lulusan Sastra
Sumber: Sekolah Brasil - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-massa-atomica.htm
