Campuran gas ini menimbulkan campuran homogen atau larutan gas. Misalnya, gas yang keluar dari cerobong asap pabrik, atau knalpot mobil, menyebar ke udara atmosfer dan, dengan berlalunya waktu, kami tidak dapat membedakannya lagi, karena ada difusi gas-gas ini melalui udara.

Gas-gas yang dikeluarkan oleh cerobong-cerobong itu menyebar dan “hilang” di udara atmosfer, karena volume udara jauh lebih besar daripada volume asap.
| NS difusi gas adalah gerakan spontan gas melalui yang lain, yaitu penyebarannya di media gas lain. |
| NS efusi gas adalah jenis difusi tertentu, di mana ada kebocoran gas melalui lubang kecil (atau dinding berpori, yang merupakan kumpulan lubang kecil). |
Misalnya, balon yang dijual kepada anak-anak diisi dengan gas helium. Seiring waktu, gas ini akhirnya melewati pori-pori karet balon, yaitu, ada efusinya. Ini ditunjukkan oleh fakta bahwa balon mengempis setelah beberapa jam.
Kimiawan Skotlandia Thomas Graham, pada tahun 1829, mempelajari perilaku gas ini. Dia menyimpulkan bahwa kecepatan di mana gas berdifusi atau keluar di tempat lain terkait dengan densitasnya. Saat data eksperimennya diulang untuk semua gas, ia menciptakan hukum berikut yang menyandang namanya:
Hukum Graham: laju difusi atau efusi gas berbanding terbalik dengan akar kuadrat densitasnya.
Secara matematis, hukum ini dapat dinyatakan dengan persamaan:
v 
Atau, menghubungkan dua gas yang berbeda, kita memiliki:
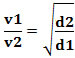
Satuan yang digunakan dalam hal ini adalah “volume yang keluar per satuan waktu”; oleh karena itu umumnya L/mnt (liter per menit).
Dengan demikian, gas dengan densitas lebih rendah berdifusi lebih cepat. Jika dalam kondisi suhu dan tekanan yang sama, Anda juga dapat membuat hubungan ini dengan massa molar gas: semakin besar kerapatan gas, semakin besar massa molarnya dan semakin rendah kecepatannya difusi; dan sebaliknya. Dengan demikian, kami memiliki:
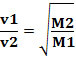
Oleh Jennifer Fogaa
Lulus kimia
Tim Sekolah Brasil
Sumber: Sekolah Brasil - https://brasilescola.uol.com.br/quimica/difusao-efusao-dos-gases.htm
