NS kelarutandapat didefinisikan sebagai jumlah maksimum zat terlarut yang dapat dilarutkan dalam sejumlah pelarut tertentu pada suhu tertentu.
Jumlah maksimum yang dapat dilarutkan ini juga dikenal sebagai koefisien kelarutan atau derajat kelarutan. Tetapi kelarutan zat tergantung, antara lain, pada jenis pelarut di mana zat terlarut terdispersi.
Misalnya, NaCl (natrium klorida - garam meja) sangat larut dalam air, dan dalam 1 L air pada 20ºC, kita dapat melarutkan hingga 360 gram garam ini. Tetapi ketika pelarut berubah menjadi bensin, pada kondisi volume, suhu, dan tekanan yang sama, garam tidak larut.
Mengapa kelarutan suatu zat sangat bervariasi dari satu pelarut ke pelarut lainnya?
Salah satu faktornya adalah polaritas dari senyawa yang terlibat. Dalam contoh yang dikutip, kita memiliki bahwa garam bersifat polar, air bersifat polar, dan bensin bersifat non-polar. Garam dibentuk oleh atom natrium (Na) dan klor (Cl) yang terikat melalui ikatan ion, di mana natrium pasti menyumbangkan elektron ke klor, membentuk ion Na
+ dan Cl-. Karena ion-ion ini memiliki muatan yang berlawanan, mereka menarik dan menahan bersama (Na+Cl-).
Ini menunjukkan kepada kita bahwa garam benar-benar polar, setiap ikatan ion bersifat polar, karena ada perbedaan muatan listrik dalam senyawa.
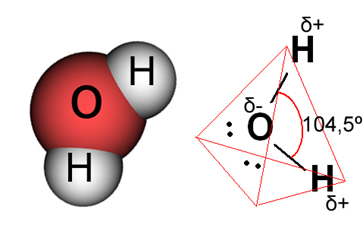
Dalam kasus air, ikatan yang ada adalah kovalen, di mana dua atom hidrogen berbagi elektron dengan atom oksigen. Molekul air memiliki dua dipol, dengan oksigen yang sebagian bermuatan negatif dan hidrogen yang sebagian bermuatan positif (δ- O H+). Tetapi, dipol-dipol ini tidak saling meniadakan, karena molekul air bertemu pada sudut 104,5º, menunjukkan bahwa distribusi dan muatan di sepanjang molekul tidak seragam. Ada kerapatan muatan negatif yang lebih besar pada atom oksigen molekul. Ini menunjukkan kepada kita bahwa molekul air benar-benar polar.
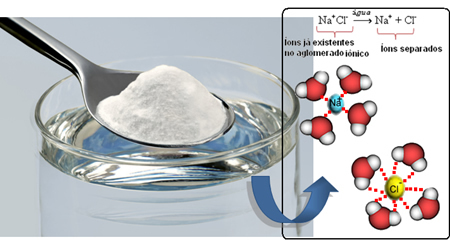
Jadi ketika kita mencampur garam ke dalam air, bagian positif dari garam itu adalah kation Na.+, ditarik oleh bagian negatif air, yaitu oksigen, dan bagian negatif garam (anion Cl-) ditarik oleh bagian positif air (H+). Akibatnya, persatuan Na+Cl- itu dipecah, melarutkan garam dalam air.
Bensin, di sisi lain, dibentuk oleh campuran hidrokarbon yang berbeda, yang non-polar, yaitu distribusi muatan listrik bensin seragam. Dengan demikian, tidak ada interaksi ion garam dengan bensin dan tidak larut.
Ini dan kasus serupa lainnya membawa kita pada kesimpulan berikut:

Namun, ini tidak dapat dianggap sebagai aturan umum, karena ada banyak kasus zat terlarut non-polar yang larut dengan baik dalam pelarut polar dan sebaliknya. Jadi, untuk memahami mengapa ini terjadi, kita harus mempertimbangkan faktor lain: jenis gaya antarmolekul dari pelarut dan zat terlarut.
Hukum tentang ini dalam teks: "Hubungan antara Kekuatan Antarmolekul dan Kelarutan Zat”.
Oleh Jennifer Fogaa
Lulus kimia
Sumber: Sekolah Brasil - https://brasilescola.uol.com.br/quimica/relacao-entre-polaridade-solubilidade-das-substancias.htm
