Anda oksida dasar mereka adalah mereka yang, ketika bereaksi dengan air, menimbulkan basa. Ketika mereka bereaksi dengan asam, mereka membentuk garam dan air.
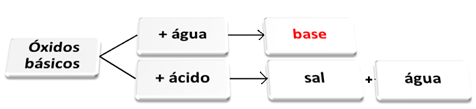
Oksida basa bereaksi dengan air dan asam.
Misalnya, kita memiliki natrium oksida (Na2O), yang merupakan oksida basa. Lihat di bawah bahwa, ketika bereaksi dengan air, ia membentuk basa natrium hidroksida:
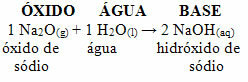
Jika oksida yang sama bereaksi dengan asam seperti asam sulfat (H2HANYA4), garam (natrium sulfat) dan air akan diproduksi.
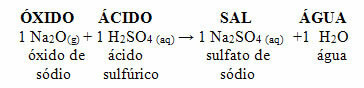
Jika oksida basa bereaksi dengan oksida asam, garam juga dihasilkan, tetapi tanpa air.
Seperti yang ditunjukkan pada contoh yang ditunjukkan, oksida basa lainnya juga merupakan senyawa ionik, yang terbentuk dalam sebagian besar oleh logam, elemen yang sangat elektropositif, biasanya menghadirkan "muatan" sama dengan +1 atau +2.
Contoh:
Pada2O = Na1+
K2O = K1+
CaO = Ca2+
MgO = Mg2+
Senyawa-senyawa ini memiliki titik leleh dan titik didih yang tinggi dan semuanya mengandung anion oksigen (O2-).
Aplikasi dari beberapa oksida dasar:
• Anjing: Kalsium oksida
Senyawa ini biasa disebut dengan kapur mentah. Ketika bereaksi dengan air, sesuai reaksi di bawah ini, terbentuk basa (kalsium hidroksida) yang digunakan untuk mengecat dinding, batang pohon dan bahan lainnya, dengan tujuan utama untuk mengusir serangga, menjaga segel dan mencegah penyusupan dari air. Basa yang terbentuk ini disebut kapur dan, oleh karena itu, ketika Anda melukis dengannya, beri nama itu cat putih.
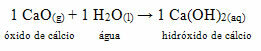

Lukisan kapur.
• K2HAI: kalium oksida
Kalium oksida banyak ditemukan pada kayu dan abu rokok. Ketika bereaksi dengan air, ia membentuk basa kalium hidroksida (KOH), yang digunakan dalam pembuatan sabun. Bahkan di masa lalu, di tempat-tempat yang tidak memiliki KOH, digunakan abu sayuran yang mengandung K .2O, untuk bereaksi dengan lemak dan menghasilkan apa yang disebut "sabun abu".
Oleh Jennifer Fogaa
Lulus kimia
Sumber: Sekolah Brasil - https://brasilescola.uol.com.br/quimica/oxidos-basicos.htm
